Acido fosforo (H3PO3)
- 4797
- 346
- Dante Morelli
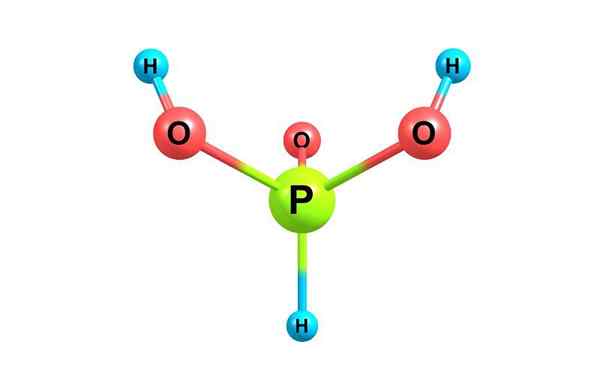
 Struttura chimica dell'acido fosforo. Con licenza
Struttura chimica dell'acido fosforo. Con licenza Cos'è l'acido fosforo?
Lui acido fosforo, Chiamato anche acido ortofosfacente, è un composto chimico di formula H3Po3. È uno dei vari acidi ossigenati del fosforo e la sua struttura è presentata nell'immagine superiore.
Data la formula composta, questo può essere riscritto come HPO (OH)2. Questa specie esiste in equilibrio con un piccolo tautomero P (OH)3.
Le raccomandazioni di Iupac, 2005, sono che quest'ultimo è chiamato acido fosforo, mentre la forma diidrossi è chiamata acido fosfonico. Solo i composti di fosforo ridotti sono incantesimi con terminazione "orso".
L'acido fosforo è un acido diprotico, ciò significa che ha solo la capacità di produrre due protoni. Questo perché il tautomero della maggioranza è h3Po3.
Quando questa forma perde un protone, la risonanza stabilizza gli anioni formati. P (OH) Tautomero 3 non ha il beneficio della stabilizzazione della risonanza. Questo rende l'eliminazione del terzo protone molto più difficile.
Acido fosforico (h3Po3) Vendite chiamate fosfiti, che sono usati come agenti riducenti. È preparato dissolvendo esossido tetraphosforico (p4O6) Secondo l'equazione:
P4O6 + 6 H₂O → 4 HPO (OH)2
Acido fosforo puro, h3Po3, È meglio preparato dall'idrolisi del tricloruro di fosforo, PCL3.
PCL3 + 3h2O → HPO (OH)2 + 3HCl
La soluzione risultante viene riscaldata per espellere l'HCL e l'acqua rimanente evapora fino a quando non appare 3Po3 cristallino colorato quando si raffreddano. L'acido può anche essere ottenuto mediante azione idrica su PBR3 o pi3.
Proprietà fisiche e chimiche del acido fosforo
- L'acido fosforo è un cristallo tetraedrico igroscopico bianco o giallo, con un aroma simile all'aglio.
Può servirti: soluzione insatura- Il h3Po3 Ha un peso molecolare di 82,0 g/mol e una densità di 1.651 g/ml.
- Il composto ha un punto di fusione di 73 ° C e si decompone sopra i 200 ° C.
- È solubile in acqua, essere in grado di dissolvere 310 grammi per 100 ml di questo solvente. È anche solubile in etanolo.
- È un acido forte con un PKA tra 1,3 e 1,6.
- Il riscaldamento dell'acido fosforo a circa 200 ° C lo rende sproporzionato su acido fosforico e fosfina (pH3). La fosfina è un gas che normalmente si accende spontaneamente nell'aria.
4h3Po3 + Calore → ph3 + 3h3Po4
Reattività e pericoli
Reattività
- L'acido fosforo non è un composto stabile.
- Assorbire l'ossigeno dell'aria per formare l'acido fosforico.
- Formare depositi gialli in soluzione acquosa che sono spontaneamente infiammabili durante l'asciugatura.
- Reagire esotermicamente con basi chimiche (ad esempio: ammine e idrossidi inorganici) per formare sali.
- Queste reazioni possono generare quantità pericolosamente grandi di calore in piccoli spazi.
- La dissoluzione dell'acqua o la diluizione di una soluzione concentrata con acqua aggiuntiva possono generare calore significativo.
- Reagisce in presenza di umidità con metalli attivi, compresi metalli strutturali come alluminio e ferro, per rilasciare idrogeno, un gas infiammabile.
- Puoi iniziare la polimerizzazione di alcuni alcheni. Reagisce con i composti cianuro per rilasciare idrogeno gassoso cianuro.
- Può generare gas infiammabili e / o tossici a contatto con ditiocarbamati, isociati, commercianti, nitruri, nitrili, solfuri e forti agenti.
- Ulteriori reazioni di generazione di gas sono prodotte con solfiti, nitriti, tiosulfati (per dare H2S e SO3), Dionitos (per dare SO2) e carbonati (per dare CO₂).
Può servirti: Einsenio (S): struttura, proprietà, ottenimento, usiPericoli
- Il composto è corrosivo per gli occhi e la pelle.
- Il contatto visivo può provocare danni corneali o cecità.
- Il contatto con la pelle può produrre infiammazione e vesciche.
- L'inalazione di polvere produrrà irritazione del tratto gastrointestinale o respiratorio, caratterizzato da bruciore, starnuti e tosse.
- Una sovraesposizione grave può causare danni ai polmoni, soffocamento, perdita di conoscenza o morte.
Azione in caso di danno
- Assicurati che il personale medico sia a conoscenza dei materiali coinvolti e prende precauzioni per proteggersi.
- La vittima deve essere spostata in un nuovo sito e chiamare il servizio medico di emergenza.
- La respirazione artificiale dovrebbe essere data se la vittima non respira.
- Il metodo della bocca a bocca non deve essere usato se la vittima ha ingerito o inalato la sostanza.
- La respirazione artificiale viene eseguita con l'aiuto di una maschera tascabile dotata di una valvola unidirezionale o di un altro dispositivo respiratorio adeguato.
- L'ossigeno dovrebbe essere somministrato se la respirazione è difficile.
- I vestiti e le scarpe contaminati devono essere rimossi e isolati.
- In caso di contatto con la sostanza, sciacquare immediatamente la pelle o gli occhi con acqua corrente per almeno 20 minuti.
- Per un contatto inferiore della pelle, il materiale deve essere evitato sulla pelle insolita.
- Mantieni la vittima calma e calda.
- Gli effetti dell'esposizione (inalazione, ingestione o contatto con la pelle) possono essere ritardati.
Usi di acido fosforo
- L'uso più importante dell'acido fosforo è la produzione di fosfiti utilizzati nel trattamento delle acque. L'acido fosforico viene anche utilizzato per preparare sali di fosfito, come la fosfita di potassio.
Può servirti: Boyle Law- I fosfiti hanno dimostrato l'efficacia nel controllo di una varietà di piante.
- In particolare, il trattamento mediante iniezione di tronco o fogliare, che contiene sali di acido fosforo, è indicato in risposta alle infezioni dovute ai patogeni vegetali di fitoftera e tipo di pithium (produrre la decomposizione della radice).
- L'acido fosforo e i fosfiti sono usati come agenti riducenti nell'analisi chimica. Una nuova sintesi comoda e scalabile di acidi fenilacetici, attraverso la riduzione catalizzata dallo ioduro di acido mandelico, si basa sulla generazione in -sitter di acido iodidecico dal sodio catalitico iodide. Per questo, l'acido fosforico viene usato come riduttore stechiometrico.
- È usato come ingrediente per la produzione di additivi utilizzati nell'industria Poli (cloruro di vinile). Anche gli esteri dell'acido fosforo sono usati in diverse reazioni della sintesi organica.
Riferimenti
- Acido fosforo (H3PO3). Recuperato dalla Britannica.com.
- Acido musico. Recuperato da EBI.AC.UK.

