Acido clorico (HCLO3)
- 2316
- 253
- Dante Morelli
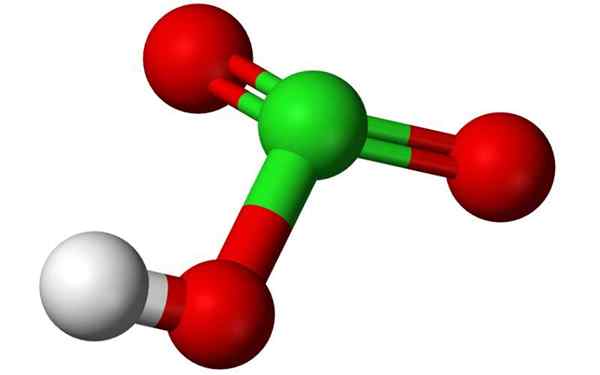
 Struttura chimica dell'acido clorico in un modello di palloncino 3D. Fonte: Benjah-BMM27, Wikimedia Commons
Struttura chimica dell'acido clorico in un modello di palloncino 3D. Fonte: Benjah-BMM27, Wikimedia Commons Cos'è l'acido clorico?
Lui acido clorico È un composto inorganico di formula HCLO3, un oxacide di cloro e precursore formale dei sali di clorato. È un forte acido in grado di donare un idrogeno a un accettore o a base Tronsted.
Il composto è ottenuto con clorato di bario (clorato di barite) con acido solforico per produrre solfato di bario, acqua insolubile in base alla seguente reazione:
BA (clo3)2 + H2SW4 → 2HCLO3 + Baso4
Un altro metodo per ottenere il riscaldamento dell'acido ipocloroso per ottenere cloro acido e cloruro di idrogeno secondo la reazione:
3HCLO → HCLO3 + 2HCl
L'acido clorico (HCLO3) è un potente ossidante dato che è in grado di ridurre gli stati di ossidazione +3, +1 e -1. Viene utilizzato per la produzione di sali di clorato.
Si decompone in concentrazioni superiori al 30%. Si rompe anche quando riscaldato, quindi deve essere mantenuto freddo sempre e tutti i barattoli di vetro utilizzati per maneggiare devono essere precedentemente refrigerati.
Proprietà fisiche e chimiche
- L'acido clorico esiste solo in soluzione. È un liquido incolore senza aroma caratteristico.
- Il composto ha un peso molecolare di 84.459 g/mol e una densità di 1 g/ml a 25 ° C.
- Ha un punto di ebollizione superiore a 100 ° C e una solubilità in acqua di 40 g per 100 ml di questo solvente a 25 ° C.
- L'acido clorico accelererà la combustione di materiali combustibili e può accendere la maggioranza in contatto. Il composto è corrosivo per metalli e tessuti.
Può servirti: coprecipitazioneAuto-reattivo
- Le concentrazioni di acido clorico sopra il 40% si decompongono.
- Solfuro di antimonio e soluzioni concentrate di acido cloralico reagiscono con l'incandescenza.
- Solfuro di arsenico e soluzioni concentrate di acido clorico reagiscono con l'incandescenza.
- Reagisce con il vigore, esplode persino con altri solfuri metallici, cioè solfuro di rame.
- In contatto con materiali ossidabili, tra cui l'ammoniaca, le reazioni possono essere estremamente violente.
- La carta da filtro si accende dopo averlo immerso in acido cloridrico.
- Le esplosioni sono state registrate mediante miscele di soluzione di acido cloralico con metalli come antimonio, bismuto e ferro. Ciò è dovuto alla formazione di composti esplosivi, incluso l'idrogeno.
Reattività e pericoli
L'acido clorico è un composto instabile. Essendo un forte acido, è estremamente pericoloso in caso di contatto con la pelle (è corrosivo e irritante), contatto visivo (irritante) e in caso di ingestione. Anche questo molto pericoloso in caso di inalazione.
Una sovraesposizione grave può causare danni ai polmoni, soffocamento, perdita di conoscenza o morte. L'esposizione prolungata può causare ustioni e ulcerazioni cutanee.
La sovraesposizione per inalazione può causare irritazione respiratoria. L'infiammazione dell'occhio è caratterizzata da arrossamento, irrigazione e prurito. L'infiammazione della pelle è caratterizzata da prurito, pelaggio, arrossamento e occasionalmente, formazione di ampoule.
La sostanza è tossica per i reni, i polmoni e le mucose. L'esposizione ripetuta o prolungata alla sostanza può causare danni a questi organi.
In caso di contatto visivo, è necessario verificare se vengono utilizzate le lenti a contatto e rimuoverle immediatamente. Gli occhi dovrebbero essere sciacquati con acqua corrente per almeno 15 minuti, mantenendo aperte le palpebre. Può essere utilizzata l'acqua fredda. Non dovrebbero essere usati fogli d'occhio.
Può servirti: acetonitrile (C2H3N)Se la sostanza chimica entra in contatto con i vestiti, mantienilo il più rapidamente possibile, proteggendo le proprie mani e il proprio corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula nella pelle esposta della vittima, come le mani, la pelle contaminata da acqua corrente e sapone non abrasiva viene lavata dolcemente e attentamente.
Puoi anche neutralizzare l'acido con idrossido di sodio diluito o con una base debole come bicarbonato di sodio. Se l'irritazione persiste, consultare il medico. Lavare l'abbigliamento contaminato prima di usarlo di nuovo.
Se il contatto con la pelle è grave, dovrebbe essere lavato con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica.
In caso di inalazione, la vittima dovrebbe essere autorizzata a stare in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il più presto possibile.
Vestiti stretti, come il collo, le cinture o la cravatta. Se la vittima è difficile da respirare, l'ossigeno deve essere somministrato. Se la vittima non respira, viene fatta una rianimazione della bocca.
Va in considerazione che può essere pericoloso per la persona che fornisce aiuto per dare la rianimazione a bocca alla bocca, quando il materiale inalato è tossico, infettivo o corrosivo.
In caso di ingestione, non induce vomito. Vestiti stretti, come collo a camicia, cinture o cravatte. Se la vittima non respira, fai la rianimazione della bocca. In tutti i casi, dovrebbero essere cercate cure mediche immediate.
Applicazioni
L'acido clorico viene utilizzato principalmente per la formazione di sali di clorato, come sodio, calcio, magnesio, stronzio, piombo, cloro di rame e argento, nonché il protocloroato e il mercurio percelore vengono preparati usando l'acido cloro come reagente come reagente come reagente.
Può servirti: attività enzimatica: unità, misurazione, regolazione e fattoriIl precursore stabile del biossido di cloro, viene utilizzato nella produzione elettrochimica di ammonio ad alta purezza.
La principale produzione di acido clorico è iniziata durante la rivoluzione industriale in Europa ed è stata utilizzata per produrre cloruro di vinile per tubi in PVC.
Un altro utilizzo per l'acido in numerose applicazioni di scala più piccola, tra cui la pulizia domestica, la produzione di gelatina e altri additivi alimentari, decalcificazione ed elaborazione in pelle.
Riferimenti
- Acido clorico (s.F.). Recuperato da Weebly.com.
- Acido clorico (s.F.). Recuperato da Chemicalbook.com.

