Struttura molecolare Acido cianidrico, Proprietà, Usi

- 990
- 25
- Rosolino Santoro
Lui acido idrocianico o L'idrogeno cianuro è un composto organico la cui formula chimica è HCN. È anche noto come metanonitril.
L'acido cianidrico è un gas incolore ed estremamente velenoso, che si ottiene nel trattamento di cianuri con acidi. Questo acido si trova all'interno del seme pacifico, noto anche in molti luoghi come una pesca.
 Seme di pesca, che contiene idrogeno cianuro o idrogeno cianuro, HCN. UN.Ha [cc by-sa 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikipedia Commons.
Seme di pesca, che contiene idrogeno cianuro o idrogeno cianuro, HCN. UN.Ha [cc by-sa 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikipedia Commons. A una temperatura ambiente inferiore a 25 ºC è un liquido e sopra quella temperatura è un gas. In entrambi i casi è estremamente tossico per l'essere umano, gli animali e persino la maggior parte dei microrganismi non acclimatati ad esso. È un buon solvente per gli ioni. È molto instabile perché tende a polimerizzare facilmente.
Si trova nel regno vegetale incorporato nelle molecole di alcuni glucosidi, perché quando vengono idrolizzati dagli enzimi della verdura, l'HCN, il glucosio e la benzaldeide si ottengono.
Questi glucosidi sono all'interno dei semi di alcuni frutti come pesche, albicocche, ciliegie, prugne e mandorle amare, quindi non dovrebbero mai essere ingerite.
Si trova anche in piante come alcuni tipi di sorgo. Inoltre, alcuni batteri lo producono durante il loro metabolismo. È principalmente utilizzato nella produzione di polimeri e in alcuni processi metallurgici.
HCN è un veleno letale a causa di inalazione, ingestione e contatto. È presente nel fumo della sigaretta e nel fumo del fuoco di plastica e materiali che contengono carbonio e azoto. È considerato un inquinante atmosferico durante la combustione di materiale organico da ampie aree del pianeta.
[TOC]
Struttura molecolare e configurazione elettronica
Idrogeno cianuro o acido cianuro è un composto covalente e molecolare, con un atomo di idrogeno, un carbonio e uno di azoto.
L'atomo di carbonio e azoto condividono 3 coppie di elettroni, quindi formano un triplo collegamento. L'idrogeno è collegato al carbonio, che con questa unione presenta il suo Valencia de Cuatro e il suo ottetto elettronico completo.
L'azoto presenta cinque Valencia di cinque e per completare il suo ottetto ha una coppia di elettroni scomparsi o solitari situati lateralmente.
L'HCN è quindi una molecola completamente lineare, con un paio di elettroni mancanti situati lateralmente in azoto.
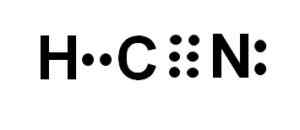 Rappresentazione di Lewis dell'acido cianidrico, dove si osservano gli elettroni condivisi in ogni legame e la coppia di elettroni di azoto solitari. Autore: Marilú Stea.
Rappresentazione di Lewis dell'acido cianidrico, dove si osservano gli elettroni condivisi in ogni legame e la coppia di elettroni di azoto solitari. Autore: Marilú Stea. 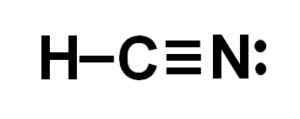 Struttura di cianuro di idrogeno o idrogeno cianuro in cui si osserva il triplo legame tra carbonio e azoto. Autore: Marilú Stea.
Struttura di cianuro di idrogeno o idrogeno cianuro in cui si osserva il triplo legame tra carbonio e azoto. Autore: Marilú Stea. Nomenclatura
- Acido idrocianico
- Acido cianidrico
- Metanonitrile
- Formonitrile
- Acido idrocianico
Proprietà
Stato fisico
Sotto 25,6 ºC, se è anidro e stabilizzato, è un liquido o blu blu pallido molto instabile e tossico. Se è al di sopra di quella temperatura è un gas incolore estremamente velenoso.
Peso molecolare
27,03 g/mol
Punto di fusione
-13,28 ºC
Punto di ebollizione
25,63 ºC (notare che bolle appena sopra la temperatura ambiente).
Punto d'infiammabilità
-18 ºC (metodo di coppa chiusa)
Temperatura di auto-direzione
538 ºC
Può servirti: gascromatografiaDensità
0,6875 g/cm3 a 20 ºC
Solubilità
Totalmente miscibile con acqua, alcol etilico ed etere etilico.
Costante di dissociazione
K = 2,1 x 10-9
PkA = 9.2 (è un acido molto debole)
Alcune proprietà chimiche
L'HCN ha una costante dielettrica molto elevata (da 107 a 25 ° C). Questo perché le loro molecole sono molto polari e sono associate da ponti idrogeno, come nel caso dell'acqua H2O.
Per avere una costante dielettrica così alta, HCN si rivela un buon solvente ionizzante.
L'HCN anidro liquido è molto instabile, tende a polimerizzare violentemente. Per evitare questo, vengono aggiunti stabilizzatori, come una piccola percentuale di H2SW4.
In soluzione acquosa e in presenza di ammoniaca e adenina ad alta pressione, composto che fa parte del DNA e dell'RNA, cioè una molecola biologicamente importante.
È un acido molto debole, poiché la sua costante di ionizzazione è molto piccola, quindi è solo parzialmente in acqua che dà l'anione cianuro CN-. Formare sali con le basi ma non con carbonati.
Le sue soluzioni acquose non protette dalla luce sono lentamente decomposti generando ammonio formiatry hcoonh4.
In soluzione presenta un odore debole di mandorle.
Corrosività
Perché è un acido debole, generalmente non è corrosivo.
Tuttavia, soluzioni acquose HCN contenenti acido solforico come stabilizzatore attaccano fortemente l'acciaio a temperature superiori a 40 ºC e in acciaio inossidabile a temperature superiori a 80 ° C.
Inoltre, le soluzioni acquose diluite HCN possono causare acciaio al carbonio anche a temperatura ambiente.
Puoi anche attaccare alcuni tipi di gomma, materie plastiche e rivestimenti.
Posizione nella natura
È relativamente abbondante nel regno vegetale che fa parte dei glucosidi.
Ad esempio, viene generato dalla tonsilin C6H5-CH (-CN) -o-glicosio-glicosio, composto presente in mandorle amare. La tonsilla è un beta-glucoside cianogenico, perché quando idrolizzato forma due molecole di glucosio, una di benzaldeide e uno di HCN. L'enzima che li rilascia è beta-glucoxidasi.
La tonsilla può essere trovata nei semi di pesche, albicocche, mandorle amare, ciliegie e prugne.
Alcuni tipi di piante di sorgo contengono la glucóside cianogenica chiamata Durrina (cioè la p-idrossi- (S) -Mandelonitrilo-beta-d-glucoside). Questo composto può essere degradato con idrolisi enzimatica a due fasi.
Innanzitutto, l'enzima Durrinosa che è endogeno nelle piante di sorgo idrolys con glucosio e p-idrossi- ((S) -Mandelonitrilo. Quindi, quest'ultimo diventa rapidamente HCN libero e P-idrossibenzaldeide.
 Pianta di sorgo con alto contenuto di Durrina. Nessun autore leggibile dalla macchina fornita. Pethan ha assunto (basato su reclami di copyright). [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Fonte: Wikipedia Commons.
Pianta di sorgo con alto contenuto di Durrina. Nessun autore leggibile dalla macchina fornita. Pethan ha assunto (basato su reclami di copyright). [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Fonte: Wikipedia Commons. HCN è responsabile della resistenza delle piante di sorgo verso parassiti e agenti patogeni.
Ciò è spiegato dal fatto che l'enzima Durrina e Durrinosa ha posizioni diverse in queste piante e entrano in contatto solo quando i tessuti sono feriti o distrutti, rilasciando l'HCN e proteggendo la pianta di infezioni che potrebbero penetrare attraverso la parte lesa.
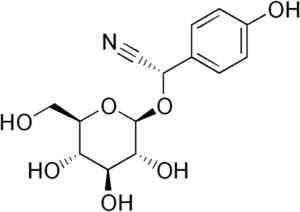 Molecola di durrina in cui si osserva il legame triplo CN che mediante idrolisi enzimatica produce HCN. EDGAR181 [dominio pubblico]. Fonte: Wikipedia Commons.
Molecola di durrina in cui si osserva il legame triplo CN che mediante idrolisi enzimatica produce HCN. EDGAR181 [dominio pubblico]. Fonte: Wikipedia Commons. Inoltre, alcuni batteri patogeni dell'essere umano come Pseudomonas aeruginosa E P. Gengivalis Lo producono durante la loro attività metabolica.
Applicazioni
Nella preparazione di altri composti chimici e polimeri
L'uso che coinvolge la maggior parte dell'HCN prodotto a livello industriale è la preparazione di intermediari per la sintesi organica.
Può servirti: ossido di ferro (ii): struttura, nomenclatura, proprietà, usiÈ usato nella sintesi adiponitrile NC- (CH2)4-CN, che viene utilizzato per preparare il nylon o il nylon, una poliammide. Serve anche a preparare Acrilonitrilo o Cianoetilene Cho2= CH-CN, usato per preparare fibre acriliche e di plastica.
Il suo cianuro di sodio derivato viene utilizzato per il recupero dell'oro nell'estrazione di questo metallo.
Un altro dei suoi derivati cloruro cloruro di cianogeno serve per le formule di pesticidi.
L'HCN viene utilizzato per la preparazione di agenti chelanti come EDTA (Etylen-Diamino-Tetra-Acetato).
Serve per la produzione di ferrocianidi e alcuni prodotti farmaceutici.
Vari usi
Il gas HCN è stato usato come insetticida, fungicida e disinfettante, per la fumigazione di navi e edifici. Anche per fumigare i mobili per ripristinarli.
HCN è stato usato in smalto metallico.
Per la sua altissima tossicità è stato nominato agente di guerra chimico.
In agricoltura
È stato usato come erbicida e pesticida nei frutteti. Aveva usato per controllare le scale e altri agenti patogeni di alberi di agrumi, ma alcuni di questi parassiti sono diventati resistenti all'HCN.
È stato anche usato per fumigare silos di grano. L'HCN gassoso preparato sul sito è stato utilizzato nella fumigazione di cereali di grano per preservarli da parassiti come insetti, funghi e roditori. Per questo uso è essenziale che i semi vengano fumigati all'agente dei pesticidi.
Test sono stati fatti semi di fumigazione di grano con HCN ed è stato scoperto che il potenziale di germinazione di questi non influisce negativamente, piuttosto sembra favorirlo.
Tuttavia, alte dosi di HCN possono ridurre significativamente la lunghezza delle piccole foglie che spuntano dal seme.
D'altra parte, a causa del fatto che si tratta di un potente nematicuro e che alcune piante di sorgo lo possiedono nei loro tessuti, il potenziale delle piante di sorgo viene studiato per essere usato come fertilizzante verde biocidico.
Il suo uso servirebbe per migliorare i terreni, sopprimere le erbacce e controllare le malattie e il danno causato dai nematodi fitoparasitici.
Rischi
Per l'essere umano, HCN è un veleno letale su tutte le rotte: inalazione, ingestione e contatto.
 Autore: clker-free-vector-images. Fonte: Pixabay.
Autore: clker-free-vector-images. Fonte: Pixabay. Inalato può essere letale. Si stima che circa il 60-70% della popolazione possa rilevare l'odore di mandorle HCN amare quando è in aria a una concentrazione di 1-5 ppm.
Ma c'è il 20% della popolazione che non può ancora rilevarlo a concentrazioni letali per non essere geneticamente in grado di farlo.
Ingerito è un veleno acuto e immediato.
Se le tue soluzioni entrano in contatto con la pelle, il cianuro associato può essere letale.
L'HCN è presente nel fumo di sigaretta e quello che viene generato quando le materie plastiche che contengono azoto vengono bruciate.
Meccanismo di azione letale all'interno dell'organismo
È una sostanza chimica ed è rapidamente tossico, portando spesso alla morte. Entrando nell'organismo, si unisce ai metalloenzimi (enzimi che contengono uno ione metallico) che li inattiva. È un agente tossico per diversi organi del corpo umano
Il suo principale effetto tossico consiste nell'inibizione della respirazione cellulare, poiché disattiva un enzima che influenza la fosforilazione nei mitocondri, che sono organelli che intervengono, tra le altre cose, nella funzione respiratoria delle cellule.
Può servirti: permanganato di potassio (KMNO4)Rischio di fumo di sigaretta
L'HCN è presente nel fumo di sigaretta.
Sebbene molte persone conoscano l'effetto dell'avvelenamento dell'HCN, poche persone si rendono conto di essere esposti al loro effetto dannoso attraverso il fumo di sigaretta.
HCN è una delle cause dell'inibizione di diversi enzimi respiratori cellulari. La quantità di HCN presente nel fumo di sigaretta ha un effetto dannoso sul sistema nervoso.
I livelli di HCN sono stati riportati nel fumo di sigaretta tra 10 e 400 μg per sigaretta per il fumo direttamente e da 0,006 a 0,27 μg/sigaretta per inalazione secondaria (fumatore passivo). HCN produce effetti tossici da 40 μm in poi.
 Autore: Foto di Alexas. Fonte: Pixabay.
Autore: Foto di Alexas. Fonte: Pixabay. Essere inalato entra rapidamente nel flusso sanguigno, dove viene rilasciato nel plasma o si lega all'emoglobina. Una piccola parte si converte in tiociarato ed è escreta dalle urine.
Rischi di riscaldamento HCN
L'esposizione prolungata al calore dell'HCN liquido in contenitori chiusi può causare una rottura violenta e inaspettata di questi. Può polimerizzare esplosivo 50-60 ºC in presenza di tracce alcalini e in assenza di inibitori.
Presenza di HCN nel fumo di fuoco
L'HCN viene rilasciato durante la combustione di polimeri che contengono azoto, come lana, seta, poliacrilonitrilos e nylon, tra gli altri. Questi materiali sono presenti nelle nostre case e nella maggior parte dei siti di attività umana.
Per questo motivo durante gli incendi l'HCN può potenzialmente essere la causa della morte per inalazione.
Inquinante dell'atmosfera
HCN è un inquinante di troposfera. È resistente alla fotólysi e nelle condizioni ambientali dell'atmosfera non subisce idrolisi.
I radicali idrossile OH • Prodotti fotochimicamente possono reagire con l'HCN, ma la reazione è molto lenta, quindi la mezza vita dell'HCN nell'atmosfera è di 2 anni.
Quando le bruciature della biomassa, in particolare MOB, HCN vengono rilasciate nell'atmosfera e anche durante le attività industriali. Tuttavia, la combustione della torba è da 5 a 10 volte più inquinante che bruciare altri tipi di biomassa.
Alcuni ricercatori hanno scoperto che alte temperature e siccità causate dal fenomeno di El Niño in alcune aree del pianeta esacerbo.
 Autore: Steve Buissinne. Fonte: Pixabay.
Autore: Steve Buissinne. Fonte: Pixabay. Questo porta a un'intensa ustioni di biomassa nelle stazioni asciutte.
Questi eventi sono la fonte di alte concentrazioni di HCN nella troposfera, che alla fine vengono trasportate nella bassa stratosfera, rimanendo per molto tempo.
Riferimenti
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- O.S. Biblioteca nazionale di medicina. (2019). Acido cianidrico. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Gidlow, d. (2017). Aggiornamento idrogeno cianuro-an. Medicina del lavoro 2017; 67: 662-663. NCBI recuperato.Nlm.NIH.Gov.
- L'enciclopedia scientifica di Van Nostrand. (2005). Acido cianidrico. 9th Estratto dalla biblioteca online.Wiley.com.
- Ren, e.-L. et al. (millenovecentonovantasei). Effetto del cianuro di idrogeno e solfuro carbonilico sulla germinazione e il vigore del plumule di grano. Pestico. Sci. 1996, 47, 1-5. Estratto dalla biblioteca online.Wiley.com.
- Da Nicola, G.R. et al. (2011). Al semplice metodo analitico per la valutazione del contenuto di dhurrin nelle piante cianogeniche per il loro uso in foraggio e biofumigazione. J. Agr. CHEM alimentare. 2011, 59, 8065-8069. Recuperato dai pub.sindrome coronarica acuta.org.
- Sheese, p.E. et al. (2017). Un potenziamento globale di cianuro di idrogeno nella stratosfera inferiore Throuppout 2016. Geophys. Manzo. Lett., 44, 5791-5797. Recuperato da Agupubs.Biblioteca online.Wiley.com.
- Surleva, a.R. e drochioiu, g. (2013). Visualizzazione pericolo di fumo: semplice determinazione spettrofotometrica dell'idrogeno cianuro nel fumo di sigaretta e nei filtri. J. Chimica. Educ. 2013, 90, 1654-1657. Recuperato dai pub.sindrome coronarica acuta.org.
- Alarie, e. et al. (1990). Ruolo dell'idrogeno cianuro nelle morti umane nel fuoco. Nel fuoco e nei polimeri. capitolo 3. Serie Symposium ACS. Recuperato dai pub.sindrome coronarica acuta.org.
- « Struttura dell'acido cromico, proprietà, ottenimento, usi
- 8 esperimenti con umani molto controversi »

