Struttura dell'acido cromico, proprietà, ottenimento, usi

- 4070
- 1261
- Lino Lombardi
Lui acido cromico o h2CRO4 L'acido associato con ossido di cromo (VI) o ossido di cromico cro è teoricamente3. Questa denominazione è dovuta al fatto che nelle soluzioni acquose acide dell'ossido cromico la specie h2CRO4 È presente con altre specie di cromo (VI).
Ossido cromico3 È anche chiamato acido cromico anidro. Il CRO3 È un solido marrone rossastro o viola che si ottiene quando si tratta di soluzioni di dicromato di potassio k2Cr2O7 Con acido solforico H2SW4.
 Crusce di ossido cromico3 In un melting pot. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikipedia Commons.
Crusce di ossido cromico3 In un melting pot. Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikipedia Commons. Le soluzioni acquose di ossido cromico sperimentano un equilibrio di alcune specie chimiche la cui concentrazione dipende dal pH della soluzione. PH di base predominando ioni di cromato cro42-, Mentre predominano gli ioni acidi HCRO4- e Cr Dicromato2O72-. Si stima che l'acido acido sia presente anche acido cromico H2CRO4.
A causa della sua grande potenza ossidante, le soluzioni di acido cromico vengono utilizzate in chimica organica per eseguire reazioni di ossidazione. Sono anche utilizzati nei processi elettrochimici per trattare i metalli in modo da acquisire resistenza alla corrosione e all'usura.
Alcuni materiali polimerici sono anche trattati con acido cromico per migliorare la loro adesione a metalli, dipinti e altre sostanze.
Le soluzioni di acido cromico sono altamente pericolose sia per l'uomo che per la maggior parte degli animali e per l'ambiente. Per questo motivo, i processi liquidi o solidi sono i rifiuti in cui viene utilizzato l'acido cromico per eliminare il cromo (VI) o per recuperare tutti gli attuali acido cromico cromico e rigenerato per riutilizzarlo.
[TOC]
Struttura
La molecola di acido cromico H2CRO4 È formato da un crollo di cromato42- e due ioni idrogeno H+ Unito a questo. Nello ione cromato l'elemento cromo è in uno stato di ossidazione di +6.
La struttura spaziale dello ione cromato è tetraedrica, dove il cromo è al centro e l'ossigeno occupa i quattro vertici del tetraedro.
Negli acido cromico gli atomi di idrogeno sono ciascuno accanto a un ossigeno. Dei quattro legami di cromo con gli atomi di ossigeno, due sono doppi e due sono semplici, in quanto hanno gli idrogeni uniti a loro.
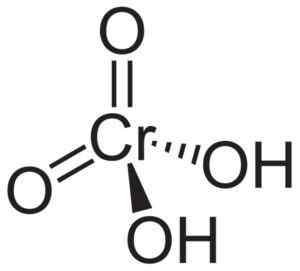 Struttura dell'acido cromico H2CRO4 dove si osservano la forma tetraedrica di cromato e i suoi doppi legami. Neuroteker [dominio pubblico]. Fonte: Wikipedia Commons.
Struttura dell'acido cromico H2CRO4 dove si osservano la forma tetraedrica di cromato e i suoi doppi legami. Neuroteker [dominio pubblico]. Fonte: Wikipedia Commons. D'altra parte, ossido croomico3 Ha un atomo cromato di ossidazione +6 circondato da soli tre atomi di ossigeno.
Nomenclatura
- Acido cromico h2CRO4
- Acido tetraoxocromico H2CRO4
- Ossido cromico (acido cromico anidro) CRO3
- Triossido di cromo (acido cromico anidro) CRO3
Proprietà
Stato fisico
Acido cromico anidro o ossido cromico è un solido cristallino di viola a rosso
Peso molecolare
CRO3: 118.01 g/mol
Punto di fusione
CRO3: 196 ºC
Sopra il suo punto di fusione è termicamente instabile, perde ossigeno (è ridotto) per dare ossido di cromo (III) CR2O3. Si decompone a circa 250 ºC.
Densità
CRO3: 1,67-2,82 g/cm3
Solubilità
Il CRO3 È molto solubile in acqua: 169 g/100 g di acqua a 25 ºC.
È solubile in acidi minerali come solforici e nitrici. Alcol solubile.
Altre proprietà
Il CRO3 È molto igroscopico, i suoi cristalli sono deliziosi.
Quando il Cro3 Si dissolve in acqua forma soluzioni fortemente acide.
Può servirti: titanio: storia, struttura, proprietà, reazioni, usiÈ un ossidante molto potente. Oxy Materia organica vigorosamente in quasi tutte le sue forme. Attacca il tessuto, la pelle e alcune materie plastiche. La maggior parte dei metalli attacca anche.
È fortemente velenoso e molto irritante a causa del suo alto potenziale ossidante.
Chimica delle soluzioni acquose in cui è presente l'acido cromico
Ossido cromico3 Si dissolve rapidamente in acqua. Nella soluzione acquosa il cromo (VI) può esistere in diverse forme ioniche.
Un pH> 6,5 o in soluzione alcalina Chrome (VI) acquisisce la forma di ioni cromato42- giallo.
Se il pH viene ridotto (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , che può dimerizzare a ioni dicromato cr2O72-, E la soluzione diventa arancione. A pH tra 2,5 e 5,5 le specie predominanti sono HCRO4- e cr2O72-.
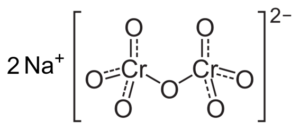 Struttura di ioni dicromato CR2O72- che è vicino a due ioni di sodio+. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikipedia Commons.
Struttura di ioni dicromato CR2O72- che è vicino a due ioni di sodio+. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikipedia Commons. I saldi che si verificano in queste soluzioni quando il pH scende sono i seguenti:
CRO42- (ioni cromato) + H+ ⇔ HCRO4-
HCRO4- + H+ ⇔ h2CRO4 (acido cromico)
2HCRO4- ⇔ Cr2O72- (Ione dicromato) + H2O
Questi saldi si verificano solo se l'acido che viene aggiunto per abbassare il pH è3 o hclo4, Perché con altri acidi si formano diversi composti.
Le soluzioni acide del dicromato sono agenti ossidanti molto energetici. Ma nelle soluzioni alcaline lo ione cromato è molto meno ossidante.
Ottenimento
Secondo le fonti consultate, uno dei modi per ottenere l'ossido di cromico CRO3, Ciò consiste nell'aggiungere l'acido solforico a una soluzione acquosa di sodio o dicromato di potassio, formando un precipitato arancione rosso.
 Acido cromico ossido idratato o cromico. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikipedia Commons.
Acido cromico ossido idratato o cromico. Himstakan [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikipedia Commons. Acido cromico h2CRO4 Si trova in soluzioni acquose di ossido cromico in mezzo acido.
Usi di acido cromico
Nell'ossidazione dei composti chimici
A causa della sua capacità fortemente ossidante, l'acido cromico è stato usato per lungo tempo e con successo per ossidare i composti organici e inorganici.
Tra gli innumerevoli esempi ci sono i seguenti: consente gli alcoli primari ossidanti agli aldeidi e questi ad acidi carbossilici, alcoli secondari ai chetoni, toluene all'acido benzoico, etilbenzene in acetofenone, trifenilmetano a trifenilcarbinolo, acido formico A Co -co2, acido ossalico a co2, acido lattico in acetaldeide e co2, Fede ferrosa2+ Una fede ferrica alla fede3+, ioduro ionico a iodio, ecc.
Consente la conversione di nitro-compensato in nitro-compositi, solfuri in solfoni. Interviene nella sintesi di chetoni basati su alcheni, come ossidato gli alcheni idroborati ai chetoni.
Composti molto resistenti ai soliti ossidanti, come l'ossigeno o2 o perossido di idrogeno H2O2, Sono ossidati dall'acido cromico. Questo è il caso di alcune bastesse eterocicliche.
Nei processi di anodizzazione metallica
L'anodizzazione dell'acido cromico è un trattamento elettrochimico che si applica all'alluminio per proteggerlo per molti anni da ossidazione, corrosione e usura.
Il processo di anodizzazione prevede la formazione elettrochimica di uno strato di ossido di alluminio o allumina sul metallo. Questo strato viene quindi sigillato in acqua calda, che si ottiene mediante conversione in ossido di alluminio triidratato.
Lo strato di ossido sigillato è spesso, ma è strutturalmente debole e non molto soddisfacente per le unioni adesive successive. Tuttavia, aggiungendo una piccola quantità di acido cromico all'acqua sigillata, viene sviluppata una superficie che può formare buoni legami.
Può servirti: legge sulla conservazione della materiaL'acido cromico nell'acqua sigillata dissolve parte della struttura cellulare di tipo spesso e lascia un sottile, forte, saldamente attaccato all'ossido di alluminio, a cui gli adesivi si attaccano e formano articolazioni forti e durature.
L'anodizzazione con acido cromico si applica anche al titanio e alle sue leghe.
Nei trattamenti di conversione chimica
L'acido cromico viene utilizzato nei processi di rivestimento metallico mediante conversione chimica.
Durante questo processo, i metalli vengono immersi in soluzioni di acido cromico. Ciò reagisce e dissolve in parte la superficie che deposita contemporaneamente un sottile strato di composti di cromo complessi che interagiscono con il metallo di base.
Questo processo è chiamato rivestimento di conversione Chromat o conversione Chrome.
I metalli che sono generalmente sottoposti a cromo di conversione sono vari tipi di acciaio, come acciaio al carbonio, acciaio inossidabile e acciaio rivestito di zinco e diversi metalli non ferrosi, come leghe di magnesio, leghe di stagno, leghe di alluminio, rame, cadmio, cadmio manganese e argento.
Questo trattamento fornisce resistenza alla corrosione e alla luminosità al metallo. Un pH più elevato del processo maggiore resistenza alla corrosione. La temperatura accelera la reazione acida.
È possibile applicare il rivestimento di vari colori, come blu, nero, oro, giallo e trasparente. Fornisce inoltre una migliore aderenza della superficie metallica verso dipinti e adesivi.
In superficie erosa o tritata
Le soluzioni di acido cromico sono usate nella preparazione della superficie del materiale termoplastico, polimeri termosibili ed elastomeri per il rivestimento successivo con dipinti o adesivi.
Il h2CRO4 ottiene un effetto sulla chimica superficiale e sulla sua struttura, perché aiuta ad aumentare la sua rugosità. La combinazione di morsi e ossidazione aumenta la penetrazione degli adesivi e può persino causare cambiamenti nelle proprietà del polimero.
È stato usato per erodere il polietilene ramificato a bassa densità, alta densità e polietilene lineare di polipropilene.
Viene utilizzato molto nell'industria dell'elettro-recept o della galvanoplastica per facilitare l'adesione del polimero metallico.
In diversi usi
L'acido cromico viene usato come conservante in legno, anche in materiali magnetici e per la catalisi delle reazioni chimiche.
Recupero dell'acido cromico
Esistono molti processi che usano l'acido cromico e generano correnti o residui che contengono cromo (III) che non possono essere scartati perché hanno ioni cromati (VI) che sono molto tossici o riutilizzati perché la concentrazione di ioni cromato è molto bassa.
La sua disposizione richiede la riduzione chimica dei cromati al cromo (III), seguita da precipitazioni di idrossido e filtrazione, che genera costi aggiuntivi.
Per questo motivo, sono stati studiati vari metodi per rimuovere e recuperare i cromati. Ecco alcuni di questi.
Tramite le resine usano
Per molti anni sono state utilizzate resine a scambio ionico per il trattamento delle acque contaminate con cromat. Questo è uno dei trattamenti approvati dalla US Environmental Protection Agency o EPA (acronimo di inglese Agenzia per la protezione ambientale).
Questo metodo consente il recupero di acido cromico concentrato poiché viene nuovamente rigenerato dalla resina.
Le resine possono essere una base forte o debole. In resine fortemente di base il cromato può essere rimosso come ioni hCro4- e cr2O72- Sono scambiati con ioni oh- e cl-. Nelle resine debolmente di base, ad esempio solfato, gli ioni vengono scambiati con SOS42-.
Può servirti: nepelometriaNel caso di resine fortemente basilari R- (OH), le reazioni globali sono le seguenti:
2roh + hCro4- + H+ ⇔ r2CRO4 + 2h2O
R2CRO4 + 2HCRO4- ⇔ 2RHCRO4 + CRO42-
R2CRO4 + HCRO4- + H+ ⇔ r2Cr2O7 + H2O
Per ogni mole di r2CRO4 Viene rimossa la conversione di un mole di Cr (vi) della soluzione, il che rende questo metodo molto attraente.
Dopo la rimozione dei cromati, la resina viene trattata con una soluzione fortemente alcalina per rigenerarli in un luogo sicuro. Quindi i cromati vengono convertiti in acido cromico concentrato per essere riutilizzati.
Attraverso la rigenerazione elettrochimica
Un altro metodo è la rigenerazione elettrochimica dell'acido cromico, che è anche un'alternativa molto conveniente. Attraverso questa procedura, il cromo (III) viene ossidato ossidalmente in cromo (VI). Il materiale anodo in questi casi è preferibilmente il biossido di piombo.
Uso di microrganismi per ripulire gli effluenti con acido cromico
Un metodo che è stato studiato ed è ancora in studio è l'uso di microrganismi presenti naturalmente in alcuni effluenti contaminati da ioni cromati esavalenti che sono il contenuto in soluzioni di acido cromico.
 Effluenti dannosi per l'ambiente. Autore: vettori di OpenClipart. Fonte: Pixabay.
Effluenti dannosi per l'ambiente. Autore: vettori di OpenClipart. Fonte: Pixabay. Questo è il caso di alcuni batteri presenti nelle acque di acque reflue dell'abbronzatura. Questi microbi sono stati studiati e determinati che sono resistenti ai cromati e sono anche in grado di ridurre il cromo (vi) a cromo (III) che è molto meno dannoso per l'ambiente e gli esseri viventi.
Per questo motivo, si stima che possano essere utilizzati come metodo ambientale per la risanamento e la disintossicazione degli effluenti contaminati da resti di acido cromico.
Rischi di acido cromico e ossido cromico
Il CRO3 Non è carburante ma può intensificare la combustione di altre sostanze. Molte delle tue reazioni possono causare fuoco o esplosione.
Il CRO3 e le soluzioni di acido cromico sono una pelle irritante potente (possono causare dermatite), gli occhi (possono bruciarle) e le mucose (possono causare bronchasma) e possono causare le "cavità cromate" così chiamate nel sistema respiratorio.
I composti cromati (VI) come acido cromico e ossido cromico sono gravemente tossici, mutageni e carcinogeni per la maggior parte degli esseri viventi.
Riferimenti
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- O.S. Biblioteca nazionale di medicina. (2019). Acido cromico. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Wegman, r.F. e Van Twisk, J. (2013). Leghe di alluminio e alluminio. 2.5. Processo di anodizzazione dell'acido cromico. Nelle tecniche di preparazione della superficie per il legame adesivo (seconda edizione). Recuperato da ScienceDirect.com.
- Wegman, r.F. e Van Twisk, J. (2013). Magnesio. 6.4. Preparazione di leghe di magnesio e magnesio dai processi di trattamento dell'acido cromico. Nelle tecniche di preparazione della superficie per il legame adesivo (seconda edizione). Recuperato da ScienceDirect.com.
- Grot, w. (2011). Applicazioni. 5.1.8. Rigenerazione dell'acido cromico. In ionomeri fluorurati (seconda edizione). Recuperato da ScienceDirect.com.
- Swift, k.G. e Booker, J.D. (2013). Processo di ingegneria superficiale. 9.7. Cromatico. Nel manuale di selezione dei processi di produzione. Recuperato da ScienceDirect.com.
- Poulson, a.H.C. et al. (2019). Tecniche di modifica della superficie di sbirciatina, incluso il trattamento della superficie plasmatica. undici.3.2.1. Incisione di superficie. In Peek Biomaterials Handbook (Second Edition). Recuperato da ScienceDirect.com.
- Westheimer, f.H. (1949). I meccanismi delle ossidazioni dell'acido cromico. Recensioni chimiche 1949, 45, 3, 419-451. Recuperato dai pub.sindrome coronarica acuta.org.
- Tan, h.K.S. (1999). RETURA ACCIO CROMICO DELL'ANIONO ECCATUALE. The Canadian Journal of Chemical Engineering, Volume 77, febbraio 1999. Estratto dalla biblioteca online.Wiley.com.
- Kabir, m.M. et al. (2018). Isolamento e caratterizzazione dei batteri di cromo (VI) da effluenti di conceria e rifiuti solidi. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI recuperato.Nlm.NIH.Gov.
- « Caratteristiche, elementi ed esempi del paesaggio industriale
- Struttura molecolare Acido cianidrico, Proprietà, Usi »

