Acido carbossilico
- 2104
- 436
- Rufo Longo
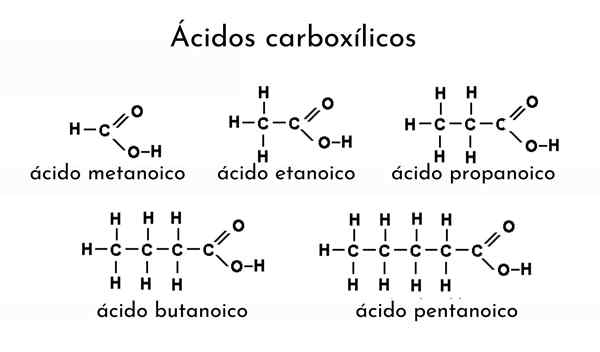
 Esempi di acidi carbossilici
Esempi di acidi carbossilici Cosa sono gli acidi carbossilici?
Lui acido carbossilico È un termine attribuito a qualsiasi composto organico contenente un gruppo carbossilico. Possono anche essere chiamati acidi organici e sono presenti in molte fonti naturali. Ad esempio, da formiche e altri insetti come lo scarabeo Gallerite, l'acido formico, un acido carbossilico viene distillato.
Cioè, un anthill è una fonte ricca di acido formico. Inoltre, l'acido acetico viene estratto dall'aceto, l'odore del burro rancido è dovuto all'acido butirrico, le erbe di Valeria contengono acido cerebrale e dai cappucci ottenuti acido caprico, tutti questi acidi carbossilici.
L'acido lattico dà il cattivo gusto del latte acido e in alcuni grassi e oli gli acidi grassi sono presenti. Gli esempi di fonti naturali di acidi carbossilici sono innumerevoli, ma tutti i loro nomi assegnati sono derivati dalle parole in latino. Quindi, in latino la parola formica significa "formica".
Poiché questi acidi venivano estratti in diversi capitoli della storia, questi nomi erano comuni, consolidando nella cultura popolare.
Formula
IL Formula generale di acido carbossilico è -r -cooh, o più dettagli: R- (c = o) -oh. L'atomo di carbonio è collegato a due atomi di ossigeno, che provoca una diminuzione della sua densità elettronica e, di conseguenza, un carico parziale positivo.
Questo carico riflette lo stato di ossidazione del carbonio in un composto organico. In ogni altro, il carbonio è arrugginito come nel caso degli acidi carbossilici, questa ossidazione è proporzionale al grado di reattività del composto.
Per questo motivo il gruppo -cooh ha una predominanza contro altri gruppi organici e definisce la natura carbonificata principale e la principale catena gassata del composto.
Quindi, non ci sono derivati acidi di ammine (R-NH2), ma Aminos derivati da acidi carbossilici (aminoacidi).
Nomenclatura
I nomi comuni derivati dal latino per gli acidi carbossilici non chiariscono la struttura del composto, o la loro disposizione o disposizione dei loro gruppi di atomi.
Data la necessità di questi chiarimenti, sorge la nomenclatura sistematica IUPAC per nominare gli acidi carbossilici.
Può servirti: bromo: storia, struttura, configurazione elettronica, proprietà, usiQuesta nomenclatura è governata da diverse regole e alcune di queste sono:
Regola 1
Per menzionare un acido carbossilico, il nome del suo alcano deve essere modificato aggiungendo il suffisso "ICO". Quindi, per etano (scegli3-Cap3) il suo corrispondente acido carbossilico è l'acido etanoico (CH3-COOH, acido acetico, lo stesso di aceto).
Un altro esempio: per Cho3Cap2Cap2-Cooh el Alcano diventa butano (ch3Cap2Cap2Cap3) e, quindi, viene nominato acido butanoico (acido butirrico, lo stesso di burro rancido).
Regola 2
Il gruppo -cooh definisce la catena principale e il numero corrispondente a ciascun carbonio viene conteggiato da carbonile.
Ad esempio, Cho3Cap2Cap2Cap2-COOH è acido pentanoico, conta da uno a cinque carboni al metile (scegli3). Se un altro gruppo metilico è collegato al terzo carbonio, sarebbe Cho3Cap2Ch (Ch3) Ch2-COOH, essendo la nomenclatura risultante ora: acido 3-metilpentanoico.
Regola 3
I sostituenti sono preceduti dal numero del carbonio a cui sono collegati. Allo stesso modo, questi sostituenti possono essere doppi o tripli collegamenti e aggiungere il suffisso "ICO" equamente ad alcheni e alcine. Ad esempio, Cho3Cap2Cap2Ch = chch2-COOH è menzionato come acido (cis o trans) 3- eptoico.
Regola 4
Quando la catena R è costituita da un anello (φ). L'acido viene menzionato che inizia con il nome dell'anello e termina con il suffisso "carbossilico". Ad esempio, il φ-cooh è chiamato acido benzecenocarbossilico.
Struttura dell'acido carbossilico
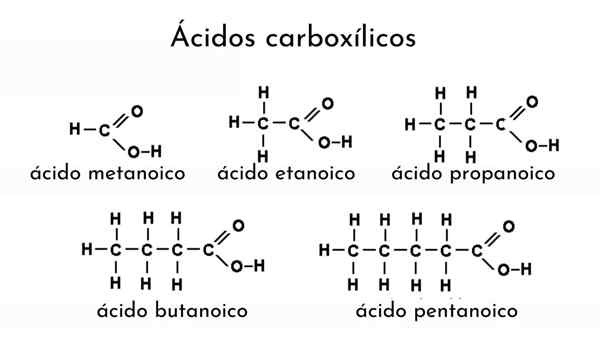
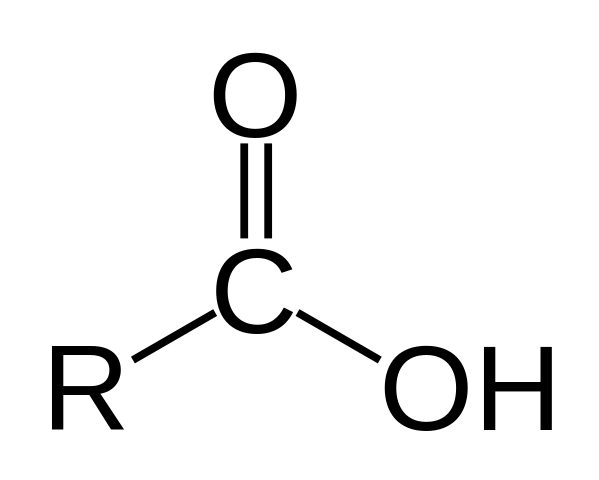 Struttura di un acido carbossilico. R è una catena idrogeno o gassata.
Struttura di un acido carbossilico. R è una catena idrogeno o gassata. Nell'immagine superiore è rappresentata la struttura generale dell'acido carbossilico. La catena laterale R può essere di qualsiasi lunghezza o possedere tutti i tipi di sostituenti.
L'atomo di carbonio ha ibridazione SP2, che consente di accettare un doppio legame e generare angoli di collegamento di circa 120º.
Pertanto, questo gruppo può essere assimilato come un triangolo piatto. L'ossigeno superiore è ricco di elettroni, mentre l'idrogeno inferiore è scarso negli elettroni, diventando un idrogeno acido (accettore elettronico). Questo è osservabile nelle strutture di risonanza a doppio legame.
L'idrogeno è assegnato a una base e per questo motivo questa struttura corrisponde a un composto acido.
Può servirti: ammineProprietà dell'acido carbossilico
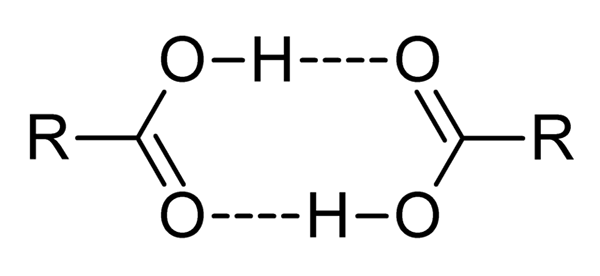
Gli acidi carbossilici sono composti molto polari, odori intensi e con la facilità di interagire efficacemente tra loro da ponti idrogeno, come illustrato dall'immagine superiore.
Quando due acidi carbossilici interagiscono in questo modo, si formano dímeros, alcuni abbastanza stabili da esistere in una fase gassosa.
I ponti di idrogeno e diametro fanno sì che gli acidi carbossilici abbiano punti di ebollizione più alti rispetto all'acqua. Questo perché l'energia fornita in calore deve evaporare non solo una molecola, ma per un dimero, anche collegato da questi ponti idrogeno.
I piccoli acidi carbossilici hanno una grande affinità per l'acqua e i solventi polari. Tuttavia, quando il numero di atomi di carbonio è maggiore di quattro, il carattere idrofobico delle catene R predomina e diventa impossibile con l'acqua.
In fase solida o liquida, la lunghezza della catena R e i sostituenti che possiede svolgono un ruolo importante. Pertanto, quando le catene sono molto lunghe, interagiscono tra loro attraverso le forze di dispersione di Londra, come nel caso degli acidi grassi.
Acidità
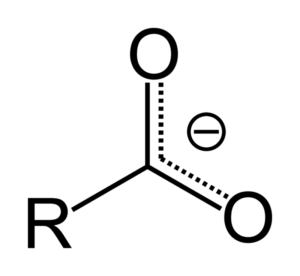
Quando l'acido carbossilico dona un protone, diventa l'anione carbossilato, rappresentato nell'immagine superiore. In questo anione il carico negativo viene trasferito tra i due atomi di carbonio, stabilizzandolo e, quindi, favorendo la reazione per verificarsi.
Come varia questa acidità da un acido carbossilico all'altro? Tutto dipende dall'acidità del protone nel gruppo OH: più povero negli elettroni, più acido.
Questa acidità può essere aumentata se uno dei sostituenti della catena RA è una specie elettronegativa (che attira o ritira la densità elettronica dall'ambiente circostante).
Ad esempio, se in Cho3-COOH viene sostituito una H del gruppo metilico con un atomo di fluoro (CFH2-COOH) L'acidità aumenta considerevolmente perché F ritira la densità elettronica da carbonile, ossigeno e quindi idrogeno. Se tutti H sono sostituiti da F (CF3-COOH) L'acidità raggiunge il suo valore massimo.
Può servirti: idrogeno: storia, struttura, proprietà e usiQuale variabile determina il grado di acidità? Il pkA. Più basso è il pkA E più vicino a 1, maggiore è la capacità dell'acido di dissociarsi in acqua e, a sua volta, più pericoloso e dannoso. Dall'esempio precedente, CF3-COOH ha il valore PK più bassoA.
Usi/applicazioni di acidi carbossilici
A causa dell'immensa varietà di acidi carbossilici, ognuno di questi ha una potenziale applicazione nel settore, che si tratti di polimeri, farmaceutica o alimento.
Industria alimentare
- Additivi.
- Conservanti (acido sorbico e acido benzoico).
- Regolatore di alcalinità di molti prodotti.
- Produzione di bevande analcoliche.
- Agenti antimicrobici prima dell'azione degli antiossidanti. In questo caso, la tendenza è antimicrobica liquida.
- Ingrediente principale di aceto comune (acido acetico).
- Acidulante in bevande carbonizzate e cibo (acido citrico e acido lattico).
- Assistente nella maturazione del formaggio svizzero (acido propionico).
- Formaggio, Chucrut, Colm fermentato e bevande analcoliche (acido lattico).
Industria farmaceutica
- Antipiretico e analgesico (acido acetilsalicilico).
- Attivo nel processo di sintesi dell'aroma, in alcuni farmaci (acido butirico o butanoico).
- Antimicotico (acido benzoico combinato con acido salicilico).
- Attivo per la produzione di medicinali di vitamina C (acido ascorbico).
- Fungicida (acido caprilico).
- Fabbricazione di alcuni lassativi (acido idrossibothanodium).
Altre industrie
- Produzione di materie plastiche e lubrificanti (acido sorbico).
- Produzione di vernici, resine elastiche e adesivi trasparenti (acido acrilico).
- Produzione di dipinti e vernici (acido linoleico).
- Produzione di saponi, detergenti, shampoo, cosmetici e prodotti per la pulizia dei metalli (acido oleico).
- Produzione di pasta dentale (acido salicilico).
- Produzione di acetato di rayon, pellicole fotografiche e solventi per vernici (acido acetico).
- PRODUZIONE DELLA DELLA E TANNEATO (ACIDO DEL METANO).
- Preparazione di oli lubrificanti, materiali impermeabili e dipinti secanti (acido palmitico).
- Produzione di gomma (acido acetico).
- Elaborazione in gomma e galvanoplastica.
- Solvente.
- Produzione di profumi (acido benzoico).
- Fabbricazione di plastificanti e resine (acido fotografico).
- Elaborazione in poliestere (acido tereftallico).
- Preparazione di candele di paraffina (acido stearico).
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. Chimica organica. Acidi carbossilici e loro derivati (decima edizione., Pagina 779-783). Wiley Plus.
- Acidi organici. Naturalwellbeing recuperato.com
- Francis a. Tartaruga. Chimica organica. Acidi carbossilici. (Sesta edizione., Pagina 805-820). Mc Graw Hill.
- William Reusch. Acidi carbossilici. Recuperato dalla chimica.MSU.Edu
- « Caratteristiche e fattori di rischio della biodiversità in Messico
- I 5 rami della biotecnologia principale »

