Struttura chimica dell'acido borico, proprietà, preparazione, usi

- 2487
- 340
- Silvano Montanari
Lui acido borico È un composto inorganico la cui formula chimica è h3Bo3. È costituito da un solido bianco o incolore. È un acido debole che nella soluzione acquosa produce, a seconda della sua concentrazione, un pH tra 3,8 e 4,8. È poco solubile in acqua calda fredda e moderatamente solubile.
L'acido borico fu scoperto nel 1702 da Wilhelm Man.
 Campione solido di acido borico su vetro dell'orologio. Fonte: Walkerma via Wikipedia.
Campione solido di acido borico su vetro dell'orologio. Fonte: Walkerma via Wikipedia. Tuttavia, si sottolinea anche che Boerg ha preparato l'acido borico aggiungendo acqua al borace e riscaldando la soluzione per evaporarla, lasciando così nel sedimento i cristalli di acido criale.
Questo acido è un composto molto utile che ha numerose applicazioni nell'industria e nella medicina, anche utilizzato come insetticida, conservazione del legno, ritardo del fuoco ed è un componente di una soluzione di smorzamento del pH.
[TOC]
Struttura chimica
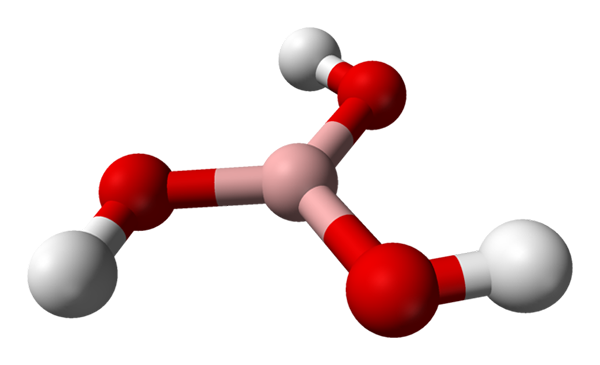 Molecola di acido borico rappresentato da un modello di sfere e barre. Fonte: Benjah-BMM27 [dominio pubblico]
Molecola di acido borico rappresentato da un modello di sfere e barre. Fonte: Benjah-BMM27 [dominio pubblico] Nell'immagine superiore abbiamo la molecola stessa di H3Bo3. Si noti che gli atomi di idrogeno, rappresentati da sfere bianche, non sono legati all'atomo di boro centrale, come potrebbe suggerire la formula chimica; ma piuttosto, per gli atomi di ossigeno, rappresentati da sfere rosse.
Pertanto, una formula più conveniente, sebbene meno usata, per l'acido borico è B (OH)3, indicando che la loro acidità è dovuta agli ioni H+ Liberato dai loro gruppi OH. Molecula B (OH)3 Ha una geometria piatta trigonale, con il suo atomo di boro con un'ibridazione chimica SP2.
Il B (oh)3 È un'alta molecola covalente, poiché la differenza di elettronegatività tra atomo di boro e ossigeno non è molto grande; Quindi i collegamenti B-O sono in sostanza covalenti. Si noti che la struttura di questa molecola ricorda quella di un filatore. Posso accendere il tuo asse allo stesso modo?
Cristalli
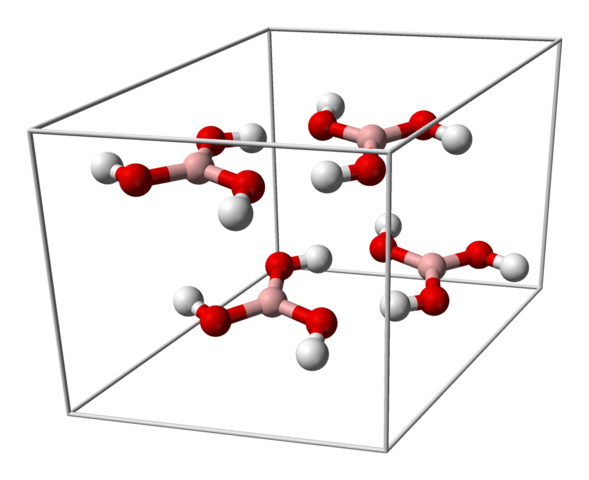 Cellula unitaria per cristallo H3Bo3. Fonte: Benjah-BMM27 [dominio pubblico]
Cellula unitaria per cristallo H3Bo3. Fonte: Benjah-BMM27 [dominio pubblico] L'immagine superiore mostra la cellula unitaria corrispondente alla struttura cristallina del triciclica per l'acido borico che, in determinate condizioni di sintesi, può adottare la struttura esagonale compatta. Si noti che ci sono quattro molecole per cellula unitaria e che sono ordinate in due strati, A e B, alternati (non sono sovrapposti l'uno sull'altro).
A causa della simmetria e della guida dei collegamenti B-OH, si può presumere che B (OH)3 È apolare; Tuttavia, l'esistenza di ponti idrogeno intermolecolari cambia la storia. Ogni molecola b (oh)3 Per dare o ricevere tre di questi ponti, con un totale di sei interazioni dipolo-dipolo, come quelle osservate nell'immagine seguente:
Può servirti: terpenos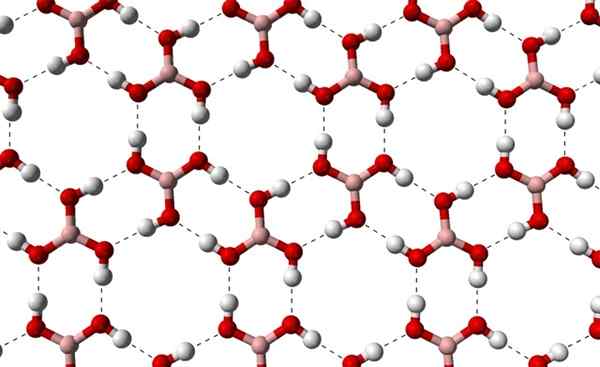 Strati cristallini di H3Bo3 osservato da un asse superiore. Fonte: Benjah-BMM27 [dominio pubblico]
Strati cristallini di H3Bo3 osservato da un asse superiore. Fonte: Benjah-BMM27 [dominio pubblico] Si noti che questi ponti idrogeno sono le interazioni direzionali che governano i cristalli di acido borico e stabiliscono modelli di aspetti ornamentali; Anelli interni forse con spazio sufficiente per occludere alcune impurità che non sono in difetti cristallini.
Questi ponti idrogeno, nonostante la bassa massa molecolare di B (OH)3, Mantengono il loro bicchiere abbastanza coerente da aver bisogno di una temperatura di 171 ºC per sciogliere. Non è noto quali effetti avrebbero elevate pressioni (nell'ordine del GPA) sugli strati molecolari di B (OH)3.
Proprietà
Nomi
Iupac: acido borico e triidrooxidobor. Altri nomi: acido ortoborico, acido borracico, sassolite, borofax e triidroxiborano.
Massa molare
61,83 g/mol
Aspetto fisico
Solido bianco cristallino, incolore e trasparente. Si ottiene anche come granuli o sotto forma di polvere bianca. Leggermente untuoso al tatto.
Odore
Gabinetto
Gusto
Leggermente amaro
Punto di fusione
170,9 ºC
Punto di ebollizione
300 ºC
Solubilità dell'acqua
Moderatamente solubile in acqua fredda e solubile in acqua calda:
2,52 g/100 ml (0 ºC)
27,50 g/100 ml (100 ºC)
L'acido borico è parzialmente solubile in acqua e tende ad affondare. Questa solubilità tende ad aumentare in presenza di acidi, come cloridrico, citrica e tartarico.
Solubilità in altri solventi
-Glicerolo: 17,5 % a 25 ° C
-Glicole etilenico: 18,5 % a 25 ° C
-Acetone: 0,6 % a 25 ° C
-Acetato di etile: 1,5 % a 25 ° C
-Metanolo: 172 g/l a 25 ºC
-Etanolo: 94,4 g/l a 25 ºC
Coefficiente di partizione ottanolo/acqua
Log p = -0.29
Acidità (PKA)
9.24. 12.4. 13.3. Queste sono le tre costanti delle rispettive dissociazioni per rilasciare H+ In acqua.
ph
3,8 - 4,8 (3,3 % in soluzione acquosa)
5,1 (0,1 molare)
Pressione del vapore
1,6 · 10-6 mmhg
Stabilità
Stabile in acqua
Decomposizione
Si rompe quando viene riscaldato sopra i 100 ºC, formando anidride borica e acqua.
Reattività
Acido borico forma sali solubili con cationi monovalenti, ad esempio: Na2B4O7.10h2Oppure e sali insolubili con cationi bivalenti, cabina4O7.6h2O.
In soluzione acquosa produce una soluzione acida, pensando che questa proprietà fosse dovuta alla sottrazione dei gruppi OH- dell'acqua. L'acido borico è qualificato come un acido debole del tipo Lewis.
L'acido borico reagisce con glicerolo e mannitolo, aumentando l'acidità dell'ambiente acquoso. La PKA viene modificata da 9,2 a 5, a causa della formazione di boro-manitol quelato [BC6H8O2(OH)2"-, che rilascia h+.
Preparazione
L'acido borico è in stato libero nelle emanazioni vulcaniche in regioni come la Toscana d'Italia, le isole lipari e nello stato del Nevada, USA. Si trova anche in minerali come borace, boracito, ulexita e colemanita.
Può servirti: alogeniL'acido borico è preparato principalmente dalla reazione del minerale di borace (tetraborato di sodio sodio) con acidi minerali, come acido cloridrico, acido solforico, ecc.
N / a2B4O9· 10h2O +HCl => 4 H3Bo3 + 2 NaCl +5 h2O
Viene anche preparato attraverso l'idrolisi di boro e diborano trihaluro.
L'acido borico viene preparato da Collemanite (CA2B6Oundici· 6 h2O). La procedura consiste nel trattamento del minerale con acido solforico per sciogliere i composti del boro.
Quindi, è separata la soluzione in cui è presente l'acido borico dei frammenti di nonno. La soluzione di idrogeno solforato viene trattata per precipitare le impurità dell'arsenico e del ferro. Il surnatante viene raffreddato per produrre un precipitato di acido borico e separarlo dalla sospensione.
Applicazioni
Nell'industria
L'acido borico viene utilizzato nell'elaborazione in fibra di vetro. Contribuendo alla riduzione del punto di fusione, aumenta la resistenza e l'efficienza della fibra di vetro tessile: materiale utilizzato per rafforzare la plastica utilizzata in vasi, tubi industriali e circuiti di computer.
L'acido borico partecipa alla produzione di vetro borosilizzato, che consente di ottenere un vetro resistente al vetro, utilizzabile nella cucina domestica, nel materiale di vetro di laboratori, tubi fluorescenti, schermi in fibra ottica, LCD, ecc.
Viene utilizzato nell'industria metallurgica per indurire e trattare le leghe in acciaio, oltre a favorire il rivestimento dei materiali in metallo.
È usato come componente chimico nella frattura idraulica (fracking): metodo utilizzato nell'estrazione di petrolio e gas. L'acido borico funge da ritardante di incendio in materiali di cellulosa, materie plastiche e tessuti che sono impregnati di acido borico per aumentare la loro resistenza al fuoco.
In medicina
L'acido borico viene usato diluito nel lavaggio degli occhi. Le capsule di gelatina di acido borico vengono utilizzate per il trattamento delle infezioni fungine, in particolare la candida albicans. È stato anche usato nel trattamento dell'acne.
L'acido borico viene cosparso di calzini per prevenire le infezioni dei piedi, come il piede dell'atleta. Allo stesso modo, le soluzioni contenenti acido borico sono usate nel trattamento dell'otite esterna nell'uomo, così come negli animali.
L'acido borico viene aggiunto nelle bottiglie utilizzate per la raccolta delle urine, il che previene la contaminazione batterica prima di essere esaminato nei laboratori diagnostici.
Può servirti: acido indoletico: struttura, proprietà, ottenimento, usiInsetticida
L'acido borico viene utilizzato nel controllo della proliferazione degli insetti, come scarafaggi, termiti, formiche, ecc. Gli scarafaggi non uccidono all'istante, poiché influisce per primo sul suo sistema digestivo e nervoso, oltre a distruggere il suo esoscheletro.
L'acido borico esercita lentamente la sua azione, permettendo agli insetti che lo hanno ingerito di entrare in contatto con altri insetti, diffondendo così l'avvelenamento.
Preservazione
L'acido borico viene utilizzato per prevenire l'attacco del legno da parte di funghi e insetti, usando a questo scopo in combinazione con l'etilenglicole. Questo trattamento è anche efficace nel controllo di limo e alghe.
Shock PH Shock
L'acido borico e la sua base coniugata formano un sistema di smorzamento PKA = 9.24, il che indica che questo ammortizzatore ha la sua più grande efficacia per il pH alcalino, che non è normale negli esseri viventi. Tuttavia, l'ammortizzatore di borato viene utilizzato nella regolazione del pH nelle piscine.
Reattori nucleari
L'acido borico ha la capacità di catturare neutroni termici, il che riduce la possibilità di una fissione nucleare non controllata in grado di produrre incidenti nucleari.
agricoltura
Boro è un elemento essenziale per la crescita delle piante, che ha indotto l'uso di acido borico per il contributo dell'elemento. Tuttavia, in eccesso l'acido borico può danneggiare le piante, in particolare gli agrumi.
Controindicazioni
L'uso di acido borico sulla pelle denudata, ferita o brucia che consente l'assorbimento dello stesso deve essere evitato. Questo è un composto tossico all'interno del corpo e in alcuni casi può causare svenimento, convulsioni, spasmi, tic facciali e ipotensione arteriosa.
Il medico dovrebbe essere consultato per l'uso di capsule vaginali di acido borico nelle donne in gravidanza, poiché è stato sottolineato che le deformazioni fetali e una diminuzione del peso corporeo del bambino alla nascita potrebbero produrre alla nascita.
Il posizionamento dell'acido borico, usato come insetticida, in luoghi disponibili per i bambini, poiché i bambini hanno una maggiore suscettibilità all'azione tossica dell'acido borico, stabilendo in essi la dose fatale in 2.000 a 3.000 mg.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). ACIDO BORICO. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). ACIDO BORICO. Database PubChem. CID = 7628. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- I redattori di Enyclopedia Britannica. (28 marzo 2019). ACIDO BORICO. Encyclopædia Britannica. Recuperato da: Britannica.com
- Vettore vibrante. (9 novembre 2018). La usa nascosta dell'acido burico nella tua vita quotidiana. Recuperato da: carriervibrazione.com
- Centro di informazione nazionale per i pesticidi. (S.F.). ACIDO BORICO. Recuperato da: NPIC.Orst.Edu
- Redazione. (30 novembre 2017). Acido borico: proprietà e usi di questo composto chimico. Estratto da: acidi.Informazioni
- Clourosodium. (2019). Acido borico. Recuperato da: clororosodium.com
- Società spagnola della farmacia ospedaliera. (S.F.). Acido borico. [PDF]. Estratto da: gruppi di lavoro.Sefh.È
- « Comparatore ottico che cosa è l'uso e le parti
- 11 Vantaggi del riciclaggio nella società (con esempi) »

