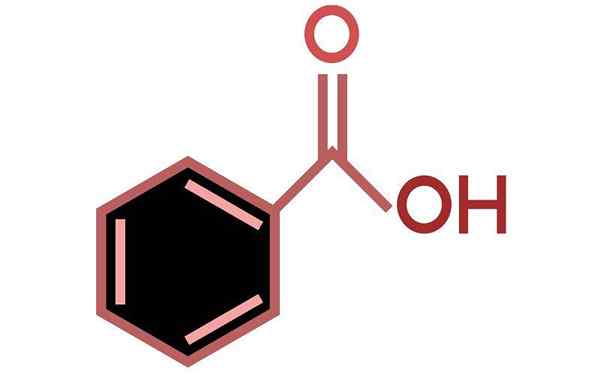
Acido benzoico (C6H5COOH)
- 4203
- 103
- Brigitta Ferrari
 L'acido benzoico è un acido carbossilico aromatico
L'acido benzoico è un acido carbossilico aromatico Cos'è l'acido benzoico?
Lui Acido benzoico È l'acido aromatico più semplice di tutti, con la formula molecolare C6H5COOH. In natura si trova in numerose piante, specialmente in frutta come albicocca e mirtillo. Si verifica anche nei batteri come sottoprodotto del metabolismo della fenilalanina aminoacido.
È generato nell'intestino dall'elaborazione batterica (ossidativa) dei polifenoli presenti in alcuni alimenti.
Il c6H5Il COOH è, a differenza di molti acidi, un composto solido, costituito da cristalli di luce, bianchi e filiformi, che emettono un aroma di mandorle e caratteristico.
Una delle principali capacità dell'acido benzoico è quella di inibire la crescita di lievito, muffa e alcuni batteri, quindi è usato come conservante alimentare.
Sebbene non sia un composto particolarmente tossico, ha alcune azioni dannose per la salute. Pertanto, l'OMS consiglia una dose massima di assunzione di 5 mg/kg di peso corporeo/giorno, equivalente a un'assunzione giornaliera di 300 mg di acido benzoico.
Struttura dell'acido benzoico
 Struttura dell'acido benzoico. Fonte: Wikimedia Commons
Struttura dell'acido benzoico. Fonte: Wikimedia Commons L'immagine superiore rappresenta la struttura dell'acido benzoico in un modello a barre e sfere.
Se vengono contati il numero di sfere nere, verrà verificato che ce ne sono sei, cioè sei atomi di carbonio, due sfere rosse corrispondono ai due atomi di ossigeno del gruppo carbossilico, -cooh e infine, le sfere bianche sono gli atomi di idrogeno.
A sinistra hai l'anello aromatico, la cui aromaticità è illustrata con le linee discontinue al centro dell'anello. E a destra, il gruppo -cooh, responsabile delle proprietà acide di questo composto.
Molecolare, il C6H5COOH ha una struttura piatta, perché tutti i suoi atomi (tranne gli idrogeni) hanno ibridazione SP2.
D'altra parte, il gruppo -cooh, altamente polare, consente a un dipolo permanente di esistere nella struttura.
Questo fatto si traduce nella C6H5COOH può interagire con se stesso attraverso le forze dipolo-dipolo. In particolare, con speciali ponti idrogeno.
Se si osserva il gruppo -cooh, si scoprirà che l'ossigeno del C = O può accettare un ponte idrogeno, mentre l'ossigeno O -h li dona.
Ponti di cristallo e idrogeno
L'acido benzoico può formare due ponti idrogeno: riceve e accetta uno contemporaneamente. Pertanto, sta formando dímeros, cioè la sua molecola è "correlata" con un altro.
Queste sono coppie o dimeri, c6H5COOH-HOOCC6H5, la base strutturale che definisce il solido derivante dalla sua pianificazione nello spazio.
Può servirti: elementi diatomiciProprietà fisiche e chimiche dell'acido benzoico
Nomi chimici
Acido:
-benzoico
-benzenocarbossilico
-Dracil
-Carboxibenzene
-benzenophoremico
Formula molecolare
C7H6O2 o c6H5COOH
Peso molecolare
122.123 g/mol.
Descrizione fisica
Solido o sotto forma di cristalli, di solito bianco, ma può presentare un colore beige se ospita determinate impurità. I suoi cristalli sono schemali o a forma di ago.
Odore
Ha un odore di mandorle ed è bello.
Gusto
Insapore o leggermente amaro. Il limite di rilevamento del sapore è di 85 ppm.
Punto di ebollizione
480º F A 760 mmHg (249 ºC).
Punto di fusione
252,3º F (121,5-123,5 ºC).
punto di accensione
250º F (121 ºC).
Sublimazione
Può sublimizzare dal 100 ºC.
Solubilità dell'acqua
3,4 g/l a 25 ºC.
Solubilità nei solventi organici
- 1 g di acido benzoico si dissolve in un volume pari a: 2,3 ml di alcool freddo, 4,5 ml di cloroformio, 3 ml di etere, 3 ml di acetone, 30 ml di tetracloruro di carbonio, 10 ml di benzene, 30 ml di disolfuro di carbonio, e 2,3 ml di olio di traffico.
- È anche solubile in oli volatili e fissi.
- È leggermente solubile nell'etere dell'olio.
- La sua solubilità in hexano è 0,9 g/l, in metanolo 71,5 g/l e in toluene 10,6 g/l.
Densità
1.316 g/ml a 82,4º F e 1.2659 g/ml a 15 ° C.
Densità del vapore
4,21 (con relazione aria presa come riferimento = 1)
Pressione del vapore
1 mmHg a 205º F e 7,0 x 10-4 MMHG a 25 ºC.
Stabilità
Una soluzione con una concentrazione dello 0,1% in acqua è stabile per almeno 8 settimane.
Decomposizione
Si decompone riscaldando, emettendo un acro e un fumo irritante.
Sostanza vischiosa
1,26 cpoise a 130 ºC.
Calore a combustione
3227 kJ / mol.
Calore di vaporizzazione
534 kJ /mol a 249 ºC.
ph
Circa 4 in acqua.
Tensione superficiale
31 n/m a 130 ºC.
PKA
Da 4,19 a 25 ºC.
Indice di rifrazione
1.504-1.5397 (ηd) a 20 ºC.
Reazioni
- In contatto con le basi (NaOH, KOH, ecc.) Formare le vendite di benzoat. Ad esempio, se reagisci con NaOH, forma di benzoato di sodio, c6H5Sentiero.
- Reagisce con gli alcoli per formare esteri. Ad esempio, la sua reazione all'alcool etilico ha origine l'estere etilico. Alcuni esteri di acido benzoico svolgono la funzione come plastificante.
- Reagisce con il pentacloruro di fosforo, PCL5, Per formare il cloruro di Benzoil, un alogenuro acido. Il cloruro di benzoil può reagire con l'ammonio (NH3) o un'ammina come la metilammina (Cho3NH2) Per formare benzamide.
- La reazione dell'acido benzoico con acido solforico produce solfonazione dell'anello aromatico. Il gruppo funzionale -so3H sostituisce un atomo di idrogeno nella posizione bersaglio dell'anello.
Può servirti: prima rivoluzione chimica- Può reagire con l'acido nitrico, con l'uso di acido solforico come catalizzatore, formando acido meta-nitrobenzoico.
- In presenza di un catalizzatore, come il cloruro ferrico, Fecl3, L'acido benzoico reagisce con gli alogeni. Ad esempio, reagisce con il cloro per la formazione di acido meta-clorobenzoico.
Produzione
Alcuni metodi di produzione di questo composto:
- La maggior parte dell'acido benzoico avviene industrialmente dal toluene ossidato con l'ossigeno presente nell'aria. Il processo è catalizzato dalla benzina di cobalto, ad una temperatura di 140-160 ºC e ad una pressione 0,2-0,3 MPa.
- Il toluene può clorare per produrre benzotricloruro, che viene successivamente idrolizzato con acido benzoico.
- L'idrolisi benzonitrile e benzamide, in un mezzo acido o alcalino, può causare acido benzoico e le sue basi coniugate.
- L'alcool benzilico in un'ossidazione mediata dal permanganato di potassio, in un mezzo acquoso, produce acido benzoico. La reazione si verifica mediante riscaldamento o distillazione di reflusso. Una volta completato il processo, la miscela viene filtrata per rimuovere il biossido di manganese, mentre il surnatante viene raffreddato per ottenere acido benzoico.
- Il composto di benzocloruro sta reagendo con idrossido di calcio, usando sali di ferro o di ferro come catalizzatori, inizialmente formando benzoato di calcio, CA (C (C6H5COO)2. Quindi questo sale, per reazione con acido cloridrico, viene convertito in acido benzoico.
Usi di acido benzoico
Industriali
- È usato nella produzione di fenolo mediante decarbossilazione ossidativa dell'acido benzoico a temperature di 300-400 ºC, perché il fenolo può essere usato nella sintesi del nylon.
- Da esso il glicole benzoato, precursore chimico dell'estere dietilenglicole e l'estere glicole trietilenico, sostanze usate come plastificanti. Forse l'applicazione più importante di plastificanti sono le formulazioni adesive. Alcuni esteri a catena lunghi vengono utilizzati per ammorbidire le materie plastiche come il PVC.
- Viene usato come attivatore di polimerizzazione in gomma. Inoltre, è un intermediario nella produzione di resine alquidiche, nonché additivi per applicazioni nel recupero di petrolio greggio.
- Inoltre, viene utilizzato nell'elaborazione di resine, coloranti, fibre, pesticidi e come agente modificante della resina di poliammide per la produzione di poliestere. Viene utilizzato per il mantenimento dell'aroma del tabacco.
Può servirti: sali binari- È un precursore del cloruro di Benzoil, che è un materiale di partenza per la sintesi di composti come il benzil benzoato, usato nell'elaborazione di sapori artificiali e insetti di insetti.
Medicinale
- È un componente dell'Ondy Whitfield. Questo unguento è composto dal 6% di acido benzoico e acido salicilico al 3%.
- È un ingrediente della tintura di benzoine, usato come inalazione di antisettico topico e decongestionante. È stato usato come espettorante, analgesico e antisettico fino all'inizio del 20 ° secolo.
- L'acido benzoico è stato usato nella terapia sperimentale di pazienti con malattie di accumulo di azoto residuo.
Conservazione del cibo
- L'acido benzoico e i suoi sali sono usati nella conservazione degli alimenti. Il composto è in grado di inibire la crescita di muffa, lievito e batteri, attraverso un meccanismo dipendente dal pH.
Sconveniente
Può reagire con l'acido ascorbico (vitamina C) presente in alcune bevande, producendo benzene, composto cancerogeno. Per questo motivo, vengono ricercati altri composti con la capacità di conservare alimenti che non presentano i problemi dell'acido benzoico.
Altri
- È usato in una confezione attiva, essendo presente negli ionomeri. Da loro viene rilasciato l'acido benzoico, in grado di inibire la crescita di generi specie Penicillium E Aspergillus Nei media microbici.
- È usato come agente conservante dell'aroma del succo di frutta e del profumo.
- L'acido benzoico viene usato come erbicida selettivo per controllare le erbacce con ampie e erbe in fagioli di soia, cetrioli, meloni, arachidi e piante ornamentali legnose.
Tossicità
- In contatto con la pelle e gli occhi può produrre arrossamento. Per inalazione può causare irritazione del respiratorio e della tosse. L'assunzione di grandi quantità di acido benzoico può causare disturbi gastrointestinali, essendo in grado di raggiungere un danno epatico e renale.
- L'acido benzoico e i benzoati possono rilasciare istamina che possono causare reazioni allergiche e irritazione degli occhi, pelle e mucose.
- Manca l'effetto cumulativo, mutageno o cancerogeno, poiché viene rapidamente assorbito nell'intestino, eliminando nelle urine senza accumulare nel corpo.
- La dose massima consentita in base all'OMS è 5 mg/kg di peso corporeo/giorno, circa 300 mg/giorno. Dose di tossicità acuta nell'uomo: 500 mg/kg.
Riferimenti
- Acido benzoico. Recuperato da Chemicalbook.com
- Acido benzoico. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov
- Acido benzoico. Recuperato da.Wikipedia.org

