Tipi di cicloossigenasi, reazione, inibitori
- 1989
- 408
- Lino Lombardi
IL Cicloossigenasi (COXS), noto anche come prostaglandina H sintasi o prostaglandina endoperossido sintesi, sono enzimi acidi grassi ossigenasi che appartengono alla superfamiglia della mieloperossidasi e trovati in tutti gli animali dei vertebrati.
Le cycossigenasi sono enzimi bifunzionali, in quanto hanno due diverse attività catalitiche: un'attività cicloossigenasi e un'altra perossidasi, che consentono loro di catalizzare Bis-Riduzione dell'ossigenazione e dell'acido arachidonico per formare prostaglandina.
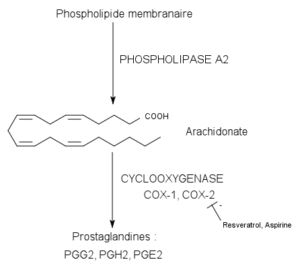 Reazione catalizzata da enzimi ciclossigenasi (fonte: pancrat [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Reazione catalizzata da enzimi ciclossigenasi (fonte: pancrat [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) Non sono stati trovati nelle piante, negli insetti o negli organismi unicellulari, ma nelle cellule vertebrate questi enzimi, vescicole, ecc.
I primi rilevamenti dei prodotti sintetizzati dalle cicloossigenasi furono effettuati in fluidi seminali, quindi inizialmente si pensava che fossero sostanze prodotte nella prostata, motivo per cui erano chiamate "prostaglandine".
Oggi è noto che le prostaglandine sono sintetizzate in tutti i tessuti degli animali vertebrati e persino in organismi che non hanno ghiandole prostatiche e che i diversi isomeri di queste molecole hanno varie funzioni in diversi processi fisiologici e patologici Sensibilità al dolore o agli algei, infiammazione, trombosi, mitogenesi, vasodilatazione e vasocostrizione, ovulazione. funzione renale, ecc.
[TOC]
Ragazzi
È stata segnalata l'esistenza di due tipi di cicloossigenasi tra animali vertebrati. Il primo ad essere scoperto e purificato è noto come COX-1 o semplicemente Cox, ed è stato purificato per la prima volta nel 1976 dalle vescicole seminali di pecore e vacche.
La seconda cicloxigenasi scoperta tra gli eucarioti era COX-2, nel 1991. Ad oggi è stato dimostrato che tutti gli animali vertebrati, inclusi pesci cartilaginei, pesci ossei, uccelli e mammiferi, hanno due geni che codificano per gli enzimi Cox.
Può servirti: circolazione dei funghi: nutrienti, sostanze, osmoregolazioneUno di loro, COX-1, codifica per la cicloossigenasi 1, che è costitutiva, mentre il gene COX-2 codifica per cicloossigenasi inducibile.
Caratteristiche di entrambi i geni e dei loro prodotti enzimatici
Gli enzimi COX-1 e COX-2 sono abbastanza simili, il che è inteso come una somiglianza del 60-65% tra le sue sequenze di aminoacidi.
I geni COX-1 Gli ortologi (geni in diverse specie che hanno la stessa origine) in tutte le specie di animali di vertebrati producono proteine COX-1 che condividono fino al 95% dell'identità delle loro sequenze di aminoacidi, che è anche vero per gli ortologi di COX-2, i cui prodotti condividono tra il 70 e il 90% di identità.
I cnidari e le ascidie hanno anche due geni Cox, Ma questi sono diversi da quelli di altri animali, quindi alcuni autori ipotizzano che questi geni avrebbero potuto emergere in eventi di duplicazione indipendenti dallo stesso antenato comune.
COX-1
Il gen Cox-1 pesa circa 22 kb ed è costitutivamente espresso per codificare la proteina COX-1, che ha circa 600 rifiuti di aminoacidi prima di essere elaborato, poiché ha un peptide di segnale idrofobico dopo la cui rimozione paga una proteina di circa 576 aminoacidi.
Questa proteina si trova principalmente nel reticolo endoplasmatico e la sua struttura generale è sotto forma di omodimero, cioè due identiche catene polipeptidiche associate alla forma di proteina attiva.
COX-2
Il gen Cox-2, d'altra parte, pesa circa 8 kb e la sua espressione è indotta da citochine, fattori di crescita e altre sostanze. Questo codifica per l'enzima COX-2 che ha, incluso il peptide del segnale, 604 rifiuti di aminoacidi e 581 dopo l'elaborazione.
Può servirti: respirazione anaerobicaQuesto enzima è anche omodimerico ed è tra il reticolo endoplasmatico e il nucleare avvolto.
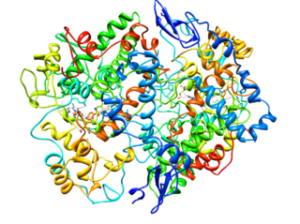 Struttura molecolare della ciclossigenasi di tipo 2 (COX-2) (fonte: citocromo C in inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Struttura molecolare della ciclossigenasi di tipo 2 (COX-2) (fonte: citocromo C in inglese Wikipedia [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) Dall'analisi delle loro strutture, è stato determinato che l'inglese dell'enzima COX-1 e COX-2 Fattore di crescita epidermico).
In questo modulo ci sono legami o ponti disolfuro estremamente conservati, che funzionano come "dominio di dimerizzazione" tra i due polipeptidi di ciascun enzima omodimerico.
Le proteine hanno anche eliche anfipatiche che facilitano l'ancoraggio a uno degli strati di membrana. Inoltre, il dominio catalitico di entrambi ha due siti attivi, uno con attività di cicloossigenasi e un altro con attività perossidasi.
Entrambi gli enzimi sono proteine estremamente conservate, essendo tra diverse specie piccole differenze significative rispetto ai meccanismi di dimerizzazione e unione sulla membrana, nonché alcune caratteristiche dei loro domini catalitici.
Le proteine Cox hanno inoltre siti di glicosilazione che sono essenziali per il loro funzionamento e che sono assolutamente conservati.
Reazione
Gli enzimi ciclossigenasi 1 e 2 sono responsabili della catalizzazione delle prime due fasi della biosintesi della prostaglandina, che iniziano con la conversione dell'acido arachidonico in precursori delle prostaglandine note come idroperoxi-engoperossido PGG2.
Affinché questi enzimi esercitino le loro funzioni, devono prima essere attivati attraverso un processo dipendente dalla loro attività perossidasi. In altre parole, la sua attività principale dipende dalla riduzione di un substrato di perossido (mediato dal sito della perossidasi attiva) in modo che si verifichi l'ossidazione del ferro associato al gruppo HEMO che funge da cofattore.
Può servirti: Monera Kingdom: caratteristiche, classificazione ed esempiL'ossidazione del gruppo HEMO provoca la formazione di un radicale tirosile nel sito attivo cicloxigenasi, che attiva l'enzima e promuove l'inizio della reazione ciclooxigenasi. Questa reazione di attivazione può verificarsi solo una volta, poiché il radicale tirosile viene rigenerato durante l'ultima reazione della rotta.
Inibitori
Le cicloossigenasi sono coinvolte nella sintesi delle prostaglandine, che sono ormoni con funzioni nella protezione della mucosa intestinale, nell'aggregazione delle piastrine e nella regolazione della funzione renale, oltre a partecipare ai processi di infiammazione, dolore e febbre.
In considerazione del fatto che questi enzimi sono fondamentali per la produzione di questi ormoni, in particolare quelli che hanno a che fare con i processi infiammatori, numerosi studi farmacologici si sono concentrati sull'inibizione delle cicloossigenasi.
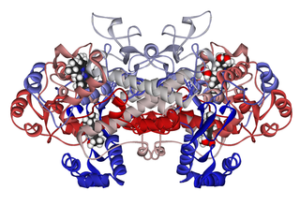 Struttura molecolare della ciclossigenasi 1 collegata all'ibuprofene (Fonte: Fvasconcellos 5 maggio 2007 [dominio pubblico] tramite Wikimedia Commons)
Struttura molecolare della ciclossigenasi 1 collegata all'ibuprofene (Fonte: Fvasconcellos 5 maggio 2007 [dominio pubblico] tramite Wikimedia Commons) Pertanto, è stato dimostrato che il meccanismo d'azione di molti farmaci antinfiammatori non steroidei ha a che fare con l'acetilazione irreversibile o reversibile (inibitoria) della cicloossigenasi del sito attivo in questi enzimi.
Tra questi farmaci ci sono piroxicam, ibuprofene, aspirina, flubiprofen, diclofenac, naprossene e altri.
Riferimenti
- Botting, r. M. (2006). Inibitori delle cicloossigenasi: meccanismi, selettività e usi. Journal of Physiology and Pharmacology, 57, 113.
- Chandrasekharan, n. V., & Simmons, D. L. (2004). Le cicloossigenasi. Genome Biology, 5 (9), 241.
- Fitzpatrick, f. A. (2004). Enzimi cicloossigenasi: regolazione e funzione. Progettazione farmaceutica attuale, 10 (6), 577-588.
- Kundu, n., Smyth, m. J., Samsel, l., & Fulton, a. M. (2002). Gli inibitori della cicloossigenasi bloccano la crescita cellulare, aumenta la ceramide e inibiscono il ciclo cellulare. Ricerca e trattamento per il cancro al seno, 76 (1), 57-64.
- Rauzer, c. A., & Marnett, L. J. (2009). Cicloossigenasi: approfondimenti strutturali e funzionali. Journal of Lipid Research, 50 (supplemento), S29-S34.
- Vane, j. R., Bakhle, e. S., E botting, r. M. (1998). Cicloossigensie 1 e 2. Revisione annuale di farmacologia e tossicologia, 38 (1), 97-120.

