Celle elettrochimiche

- 4097
- 1203
- Baldassarre Ross
Cosa sono le celle elettrochimiche?
IL celle elettrochimiche Sono dispositivi in cui passano le reazioni chimiche in cui l'energia chimica viene trasformata in elettricità o viceversa. Queste cellule costituiscono il cuore dell'elettrochimica, l'anima è il potenziale scambio di elettroni che possono verificarsi, spontanei o non spontaneamente, tra due specie chimiche.
Una delle due specie si ossida, perde elettroni, mentre l'altra è ridotta vincendo gli elettroni ceduti. Comunemente la specie ridotta è un catione metallico in soluzione, che guadagnando elettricamente finisce per essere elettricamente su un elettrodo realizzato con lo stesso metallo. D'altra parte, la specie che ossida è un metallo, diventando cationi metallici.
 Diagramma di cellule elettrochimiche di Daniel. Fonte: Rechua [CC di (https: // creativeCommons.Org/licenze/di/3.0)]
Diagramma di cellule elettrochimiche di Daniel. Fonte: Rechua [CC di (https: // creativeCommons.Org/licenze/di/3.0)] Ad esempio, l'immagine superiore rappresenta la cella di Daniel: la più semplice di tutte le celle elettrochimiche. L'elettrodo di zinco metallico viene ossidato, rilasciando cationi Zn2+ all'ambiente acquoso. Ciò si verifica nel contenitore ZnSO4 da sinistra.
A destra, la soluzione contenente CUO4 È ridotto, trasformando i cationi cu2+ Nel rame metallico che si deposita sull'elettrodo di rame. Durante lo sviluppo di questa reazione, gli elettroni viaggiano un circuito esterno che attiva i loro meccanismi; E quindi, fornendo elettricità per il funzionamento di un'attrezzatura.
Componenti cellulari elettrochimici
Elettrodi
Nelle celle elettrochimiche vengono generate o consumate. Per garantire il corretto flusso di elettroni ci devono essere materiali che sono buoni conduttori di elettricità. È qui che vengono gli elettrodi e il circuito esterno, dotati di cablaggio di rame, argento o oro.
Gli elettrodi sono i materiali che forniscono la superficie in cui verranno sviluppate reazioni nelle celle elettrochimiche. Esistono due tipi in base alla reazione che si verifica in essi:
- Anodo, elettrodo in cui si verifica l'ossidazione.
- Catodo, elettrodo in cui si verifica la riduzione.
Gli elettrodi possono essere realizzati con materiale reagente, come nel caso della cellula di Daniel (zinco e rame); oppure, di materiale inerte, come nel caso in cui sono realizzati in platino o grafite.
Gli elettroni assegnati dall'anodo devono raggiungere il catodo; Ma non attraverso una soluzione, ma viaggiare un cavo metallico che unisce entrambi gli elettrodi a un circuito esterno.
Dissoluzione degli elettroliti
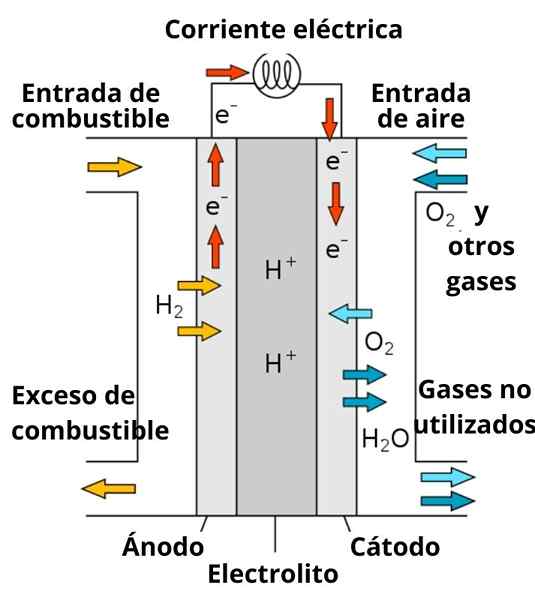 Schema di una batteria al carburante conduttiva protoni
Schema di una batteria al carburante conduttiva protoni Anche la dissoluzione che circonda gli elettrodi svolge un ruolo importante, in quanto è arricchito con forti elettroliti; come: kcl, kno3, NaCl, ecc. Questi ioni favoriscono in una certa misura la migrazione degli elettroni dall'anodo al catodo, nonché la loro conduzione da parte delle vicinanze degli elettrodi per interagire con la specie per ridurre.
L'acqua di mare, ad esempio, conduce elettricità molto migliore rispetto all'acqua distillata, con una concentrazione di ioni più bassa. Ecco perché le celle elettrochimiche hanno una soluzione di elettroliti forti tra i loro componenti.
Ponte salino
Gli ioni della soluzione iniziano a circondare gli elettrodi causando una polarizzazione dei carichi. La dissoluzione attorno al catodo inizia a caricare negativamente, poiché i cationi vengono ridotti; Nel caso della cellula di Daniel, Cu Cations2+ Depositando come rame metallico sul catodo. Pertanto, c'è un deficit di addebiti positivi.
È qui che interviene il ponte salino per bilanciare i carichi e impedire che gli elettrodi vengano polarizzati. Sul lato o il compartimento dei cationi catodici del ponte salino migreranno, K+ o Zn2+, Per soppiantare il CU2+ consumato. Nel frattempo, dal ponte salino non migrerà gli anioni3- Verso il compartimento anodo, per neutralizzare la crescente concentrazione di zn cationi2+.
Può servirti: dicromato di potassio: formula, proprietà, rischi e usiIl ponte salino è composto da una soluzione di sali saturi, con le sue estremità coperte da un gel ionico permeabile, ma impermeabile per l'acqua.
Tipi di celle elettrochimiche e come funzionano
Il modo in cui funziona una cella elettrochimica dipende dal tipo che è. Ci sono fondamentalmente due tipi: galvanico (o voltaico) ed elettrolitico
Galvanica
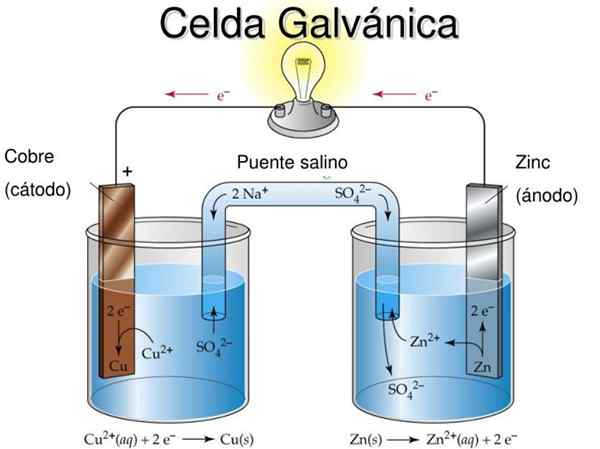
Daniel's Cell è un esempio di una cella elettrochimica galvanica. In esse le reazioni si verificano spontaneamente e il potenziale della batteria è positivo; Maggiore è il potenziale, maggiore è l'elettricità che fornirà la cella.
Le batterie o le batterie sono celle galvaniche precisamente: il potenziale chimico tra i due elettrodi viene trasformato in energia elettrica quando interviene un circuito esterno che le collega. Pertanto, gli elettroni migrano dall'anodo, accendono l'apparecchiatura a cui è collegata la batteria e vengono restituiti direttamente al catodo.
Elettrolitico
Le cellule elettrolitiche sono quelle le cui reazioni non si verificano spontaneamente, a meno che non siano fornite da energia elettrica da una sorgente esterna. Qui si verifica il fenomeno opposto: l'elettricità consente di sviluppare reazioni chimiche non spontanee.
Una delle reazioni più note e preziose che si svolgono all'interno di questo tipo di cellula è l'elettrolisi.
Le batterie ricaricabili sono esempi di elettrolitico e allo stesso tempo galvanico: vengono ricaricate per invertire le loro reazioni chimiche e ristabilire le condizioni iniziali per riutilizzare di nuovo.
Esempi
Daniel's Cell
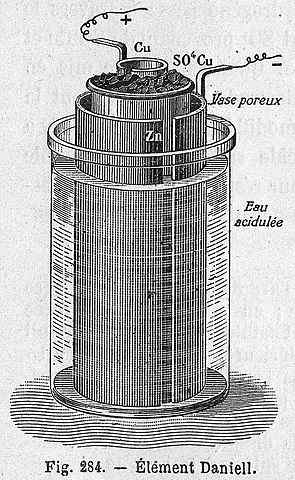 Schema cellulare di Daniel
Schema cellulare di Daniel La seguente equazione chimica corrisponde alla reazione della cellula di Daniel, dove partecipano zinco e rame:
Può servirti: affitto alogenuro: proprietà, ottenimento, esempiZn (s) + cu2+(AQ) → Zn2+(aq) + cu (s)
Ma cationi2+ e Zn2+ Non sono soli ma accompagnati dagli anioni così42-. Questa cella può essere rappresentata come segue:
Zn | Znso4 | | Cuso4 | Cu
La cella di Daniel può essere costruita in qualsiasi laboratorio, essendo molto ricorrente come pratica nell'introduzione dell'elettrochimica. Come Cu2+ È depositato come Cu, il colore blu della soluzione CuSo4 Andrà perso.
Platino e cellula idrogeno
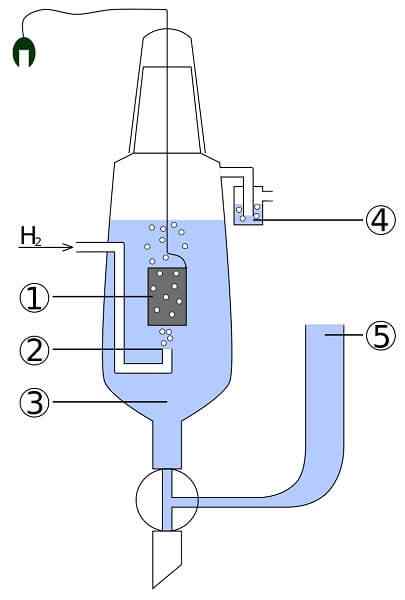 Schema di un platino e cella di idrogeno: 1. 2 elettrodo platino. Idrogeno gas 3. Soluzione acida 4. Hidroseal 5. Deposito sindacale
Schema di un platino e cella di idrogeno: 1. 2 elettrodo platino. Idrogeno gas 3. Soluzione acida 4. Hidroseal 5. Deposito sindacale Immagina una cellula che consuma idrogeno gassoso, produce argento metallico e allo stesso tempo impiega l'elettricità. Questa è la cellula di platino e idrogeno, e la sua reazione generale è la seguente:
2AGCL (S) + H2(g) → 2ag (s) + 2h+ + 2cl-
Qui nel compartimento anodo abbiamo un elettrodo di platino inerte, immerso in acqua e a cui l'idrogeno a gas viene pompato. Il h2 essere ossidato a h+ e produce i suoi elettroni al precipitato lattiginoso di AGCL nel compartimento catodo con un elettrodo in argento in metallo. AgCl sarà ridotto su questo argento e l'impasto dell'elettrodo aumenterà.
Questa cella può essere rappresentata come:
Pt, h2 | H+ | | Cl-, Agcl | Ag
Downs Cell
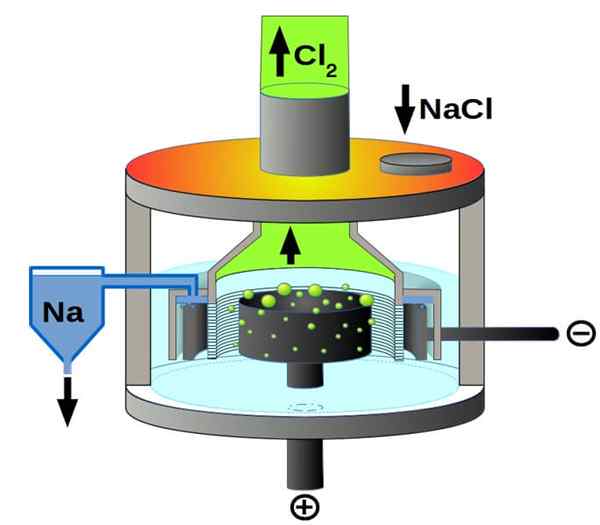 Downs Cell Schema per l'elettrolisi del cloruro di sodio. Fonte: Pchemiker, CC BY-SA 4.0, via Wikimedia Commons
Downs Cell Schema per l'elettrolisi del cloruro di sodio. Fonte: Pchemiker, CC BY-SA 4.0, via Wikimedia Commons E infine, tra le cellule elettrolitiche abbiamo il cloruro di sodio fuso, meglio noto come Downs Cell. Qui viene fatta l'elettricità per viaggiare attraverso gli elettrodi un volume di NaCl fuso, e quindi proviene da esse le seguenti reazioni:
2 °+(l) + 2e- → 2na (s) (catodo)
2cl-(L) → CL2(g) + 2e- (anodo)
2NACL (L) → 2NA (S) + CL2(g) (reazione globale)
Pertanto, grazie all'elettricità e al cloruro di sodio, possono essere preparati il sodio metallico e il gas cloro.

