Parti cellulari galvaniche, come funziona, applicazioni, esempi

- 2618
- 521
- Kayla Serr
IL Cellula galvanica o cella voltaica è un tipo di cella elettrochimica che è costituita da due diversi metalli immersi in due semi -lladi, in cui un composto in soluzione attiva è una reazione spontanea.
Quindi, uno dei metalli in uno dei semi -lladi viene ossidato mentre il metallo dell'altro semi -media è ridotto, producendo uno scambio di elettroni attraverso un circuito esterno. Ciò consente di sfruttare la corrente elettrica.
 Figura 1. Schema e parti di una cellula galvanica. Fonte: Corinth.Pucp.Edu.PE.
Figura 1. Schema e parti di una cellula galvanica. Fonte: Corinth.Pucp.Edu.PE. Il nome di "Galvanic Cell" è in onore di uno dei pionieri della sperimentazione con l'elettricità: il medico e fisiologo italiano Luigi Galvani (1737-1798).
Galvani scoprì nel 1780 che se si unirono da cavi di un finale di diversi metalli e le estremità libere furono messe in contatto con l'ANCA di una rana (morta), allora si è verificata una contrazione.
Tuttavia, il primo a costruire una cella elettrochimica per produrre elettricità fu anche l'Alessandro Volta italiano (1745-1827) nel 1800 e quindi il nome alternativo della cella voltaica.
Parti della cellula galvanica
Le parti di una cella galvanica sono mostrate nella Figura 1 e sono le seguenti:
1.- Semi -media anodico
2.- Elettrodo di anodio
3.- Soluzione anodica
4.- Semi -media catodica
5.- Elettrodo catodico
6.- Soluzione catodica
7.- Ponte salino
8.- Direttore metallico
9.- Voltmetro
Funzionamento
Per spiegare il funzionamento di una cella galvanica, faremo affidamento su quello inferiore:
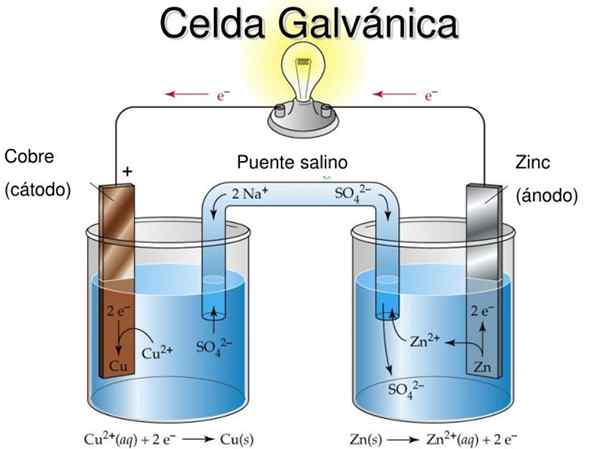 figura 2. Modello didattico di cellule galvaniche. Fonte: slideserve.com
figura 2. Modello didattico di cellule galvaniche. Fonte: slideserve.com L'idea fondamentale di una cella galvanica è che il metallo subito dalla reazione di ossidazione è fisicamente separato dal metallo che viene ridotto, in modo che lo scambio di elettroni si verifichi attraverso un conduttore esterno che consente di sfruttare il flusso di corrente elettrica , Ad esempio per illuminare un bulbo o un LED.
Nella Figura 2 nella semi -media a sinistra hai un nastro di rame metallico (Cu) immerso in una soluzione di solfato di rame (CUS04), Mentre nel semi -lid giusto c'è un nastro di zinco (Zn) immerso in una soluzione di solfato di zinco (Znso4).
Va notato che in ogni semi -media il metallo di ciascuno è presente in due stati di ossidazione: gli atomi di metallo neutro e gli ioni metallici del sale dello stesso metallo in soluzione.
Se i nastri metallici non sono collegati da un cavo conduttivo esterno, entrambi i metalli si ossidano separatamente nelle rispettive cellule.
Tuttavia, quando è collegato elettricamente, l'ossidazione si verificherà nella Zn mentre ci sarà una reazione di riduzione in Cu. Questo perché il grado di ossidazione dello zinco è maggiore di quello del rame.
Il metallo che ossida produce al metallo che viene ridotto attraverso il conduttore esterno e questo flusso di corrente può essere utilizzato.
Può servirti: derivati alogenatiReazioni di ossidazione e riduzione
La reazione che si verifica sul lato destro tra l'elettrodo metallico di zinco e la soluzione acquosa di solfato di zinco è la seguente:
ZnO(S) + Zn2+ (SW4)2- → 2 Zn2+(AC) + (SW4)2- + 2 e-
Un atomo di zinco (solido) sulla superficie dell'elettrodo anodico nel semi -diritto della destra, stimolato dagli ioni positivi dello zinco in soluzione, produce due elettroni ed emerge dall'elettrodo, andando alla soluzione acquosa Come un doppio ione positivo di zinco.
Ci siamo resi conto che il risultato netto era che un atomo di zinco metallico neutro, perdendo due elettroni, divenne uno ione di zinco che si aggiunge alla soluzione acquosa, in modo che la barra di zinco perse un atomo e la soluzione acquisisse una doppia ioni.
Gli elettroni liberati preferiranno muoversi attraverso il cavo esterno verso il metallo dell'altro semi -media con carico positivo (CARTODO +). La barra di zinco sta perdendo la massa poiché i suoi atomi passano gradualmente alla soluzione acquosa.
L'ossidazione dello zinco può essere riassunta come segue:
ZnO(S) → Zn2+(AC) + 2 e-
La reazione che si verifica sul lato sinistro è simile, ma il rame della soluzione acquosa cattura due elettroni (provenienti dall'altro semi -tema) e viene depositato nell'elettrodo di rame. Quando un atomo cattura gli elettroni, si dice che sia ridotto.
La reazione di riduzione del rame è scritta in questo modo:
Cu2+(AC) + 2 e- → CuO(S)
La barra di rame sta guadagnando impasto, poiché gli ioni della soluzione passano alla barra.
L'ossidazione si verifica nell'anodo (negativo), che respinge gli elettroni, mentre la riduzione si verifica nel catodo (positivo), che attira elettroni. Lo scambio di elettroni avviene attraverso il driver esterno.
Il ponte salino
Il ponte salino bilancia i carichi che si accumulano nei due semi -se. Negli ioni semi -diadici positivi anodici si accumulano, mentre nel catodico c'è un eccesso di ioni di solfato negativi.
Per il ponte salino viene utilizzata una soluzione di un sale (come cloruro di sodio o cloruro di potassio) che non intervenga nella reazione, che si trova in un tubo a forma di U invertito con le sue estremità collegate con una parete di materiale poroso.
L'unico scopo del ponte salino è che gli ioni vengano filtrati su ciascun bilanciamento o neutralizzando il carico in eccesso. Pertanto, attraverso il ponte salino c'è un flusso di corrente, attraverso gli ioni salini, che chiude il circuito elettrico.
Potenziali di ossidazione e riduzione
Sono compresi i potenziali di ossidazione e riduzione standard.
Può servirti: scandio: storia, proprietà, reazioni, rischi e usiPer lo zinco il suo potenziale di ossidazione standard èbue = +0,76 v. Nel frattempo, il potenziale di riduzione standard per il rame è egriglia = +0,34 v. La forza elettromotiva (FEM) prodotta da questa cellula galvanica è: FEM = +0,76 V + 0,34 V = 1,1 V.
La reazione globale della cellula galvanica può essere scritta in questo modo:
ZnO(S) + Cu2+(AC) → Zn2+(AC) + CuO(S)
Tenendo conto del solfato La reazione netta è:
ZnO(S) + Cu2+ (SW4)2- 25ºC → Zn2+ (SW4)2-+ CuO(S)
Il solfato è uno spettatore, mentre i metalli si scambiano elettroni.
Rappresentazione simbolica di una cellula galvanica
La cellula galvanica della Figura 2 è simbolicamente rappresentata come segue:
ZnO(S)| Zn2+(AC) (1m) || Cu2+(AC) (1m) | cuO(S)
Per convenzione, a sinistra il metallo che ossida e forma l'anodo (-) e separato da una barra (|) il suo ione in stato acquoso è sempre posizionato. Il semi -medio anodico è separato dal catodico da due bar (||) che rappresenta il ponte salino. A destra, il semi -medio in metallo che viene ridotto e forma il catodo (+).
Nella rappresentazione simbolica di una cellula galvanica l'estremità è sempre il metallo che si ossida e alla fine il metallo viene posizionato (in stato solido) che viene ridotto. Va notato che nella Figura 2 i semicel sono al contrario rispetto alla rappresentazione simbolica convenzionale.
Applicazioni
Conosciuto i potenziali di ossidazione standard di diversi metalli è possibile determinare la forza elettromotrice che produrrà una pila galvanica costruita con questi metalli.
In questa sezione, quanto sopra si applicherà nelle sezioni precedenti per calcolare la forza elettromotoria netta di una cella costruita con altri metalli.
Come esempio di applicazione consideriamo una cellula di ferro galvanica (fede) e un rame (CU). Come dati, vengono fornite le seguenti reazioni di riduzione e il suo potenziale di riduzione standard, ovvero a 25 ° C e concentrazione di 1M:
Fede2+(AC) + 2 e- → Fede(S). E1griglia = -0,44 v
Cu2+(AC) + 2 e- → Cu(S). E2griglia = +0,34 v
È richiesto di trovare la forza elettromotoria netta prodotta dalla seguente cella galvanica:
Fede(S)| Faith2+(AC)(1m) || Cu2+(AC)| Cu(S)
In questa pila il ferro è ossidante ed è l'anodo della cellula galvanica, mentre il rame viene ridotto ed è il catodo. Il potenziale di ossidazione del ferro è lo stesso ma al contrario del suo potenziale di riduzione, vale a dire E1Oxd = +0.44.
Per ottenere la forza elettromotrice prodotta da questa cella galvanica, aggiungiamo il potenziale di ossidazione del ferro con il potenziale di riduzione del rame:
Può servirti: ossidi di azoto (NOX)fem = e1Oxd + E2griglia = -E1griglia + E2griglia = 0,44 V + 0,34 V = 0,78 V.
Cellula galvanica nella vita quotidiana
Le cellule galvaniche per l'uso quotidiano sono lontane dalla forma usata come modello didattico, ma il loro principio di funzionamento è lo stesso.
La cella di uso più comune è la batteria alcalina da 1,5 V nelle sue diverse presentazioni. Il primo nome arriva perché è un insieme di celle collegate in serie per aumentare il FEM.
Le batterie al litio ricaricabili si basano anche sullo stesso principio di funzionamento delle celle galvaniche e sono quelle utilizzate in smartphone, orologi e altri dispositivi.
Allo stesso modo le batterie piombo di auto, motociclette e barche sono 12v e si basano sullo stesso principio di funzionamento della cella galvanica.
Le cellule galvaniche sono usate in estetica e rigenerazione muscolare. Esistono trattamenti facciali che consistono nell'applicazione della corrente da parte di due elettrodi sotto forma di un rullo o una sfera che pulisce e tonificano la pelle.
Gli attuali impulsi si applicano anche per rigenerare la muscolatura nelle persone che si trovano in uno stato di prostrazione.
Costruzione di una cellula galvanica fatta in casa
Esistono molti modi per costruire una cellula galvanica fatta in casa. Uno dei più semplici è usare l'aceto come soluzione, chiodi in acciaio e cavi di rame.
Materiali
-Navi in plastica usa e getta
-aceto bianco
-Due viti in acciaio
-Due pezzi di filo di rame nudo (senza isolamento o vernice)
-Un voltmetro
Procedura
-Riempi ¾ parti del vetro con aceto.
-Unisci le due viti in acciaio con diverse giri di filo, lasciando un pezzo di filo senza avvolgimento.
L'estremità infinita del cavo di rame viene piegata in una forma di U invertita.
 Figura 3. Cellula galvanica fatta in casa e multimetro. Fonte: YouTube.com
Figura 3. Cellula galvanica fatta in casa e multimetro. Fonte: YouTube.com Un altro pezzo di cavo di rame viene anche piegato in un invertito e si blocca sul bordo del vetro in una posizione diametralmente opposta alle viti sommerse, in modo che una parte del rame sia all'interno dell'aceto e l'altra parte del cavo di rame all'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'esterno dell'osta il vetro.
Le estremità libere dei cavi del voltmetro sono collegate per misurare la forza elettromotrice prodotta da questa semplice cella. Il fem di questo tipo di cellula è 0,5 V. Per abbinare il FEM di una batteria alcalina, è necessario costruire altre due celle e unirsi alle tre in serie, in modo da ottenere una batteria da 1,5 V
Riferimenti
- Borneo, r. Celle galvaniche ed elettrolitiche. Estratto da: lezioni Quimica.Blogspot.com
- Cedrón, j. Chimica generale. Pucp. Recuperato da: Corinth.Pucp.Edu.PE
- Farrera, l. Introduzione all'elettrochimica. Dipartimento di fisicoCochimica Unam. Recuperato da: Depa.Fquim.UNAM.MX.
- Wikipedia. Cella elettrochimica. Recuperato da: è.Wikipedia.com.
- Wikipedia. Cellula galvanica. Recuperato da: è.Wikipedia.com.

