Struttura di carbonato di potassio (K2CO3), proprietà, usi, ottenendo

- 2660
- 266
- Lino Lombardi
Lui Carbonato di potassio È un composto inorganico formato da due ioni di potassio k+ e uno ione carbone co32-. La sua formula chimica è k2Co3. È un solido bianco igroscopico, cioè assorbe facilmente l'acqua dall'ambiente. Pertanto nei laboratori viene utilizzato per assorbire l'acqua da altre sostanze.
È molto solubile in acqua che forma soluzioni alcaline, che sono ricche di ioni OH-e quindi con un alto valore di pH. Le sue soluzioni acquose, perché sono alcaline, sono utilizzate in diversi processi industriali per assorbire gas acidi come l'anidride carbonica2 e idrogeno solforato H2S, quindi li neutralizza facilmente.
 Carbonato di potassio k2Co3 solido. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons.
Carbonato di potassio k2Co3 solido. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons. Il k2Co3 Viene utilizzato per preparare saponi, prodotti per la pulizia, detergenti per lavare i vestiti e le miscele per lavare i piatti. Viene anche utilizzato nell'elaborazione di alcune fibre tessili come la lana.
È ampiamente utilizzato nei laboratori di chimica, ad esempio per assorbire l'acqua da altri composti o per alcalizzare le miscele di reazioni chimiche e anche nell'analisi chimica.
Viene anche aggiunto ad alcuni alimenti, ad esempio, per eliminare il gusto amaro dei semi di cacao durante la produzione di cioccolato.
[TOC]
Struttura
Il carbonato di potassio è costituito da due cationi di potassio+ e un anione carbonato co32-. L'anione carbonato ha una struttura piatta e simmetrica, mentre i tre atomi di ossigeno circondano il carbonio che forma un triangolo piatto.
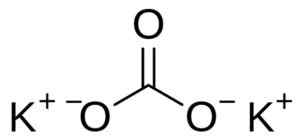 Struttura del carbonato di potassio K2Co3. Utente: EDGAR181 [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura del carbonato di potassio K2Co3. Utente: EDGAR181 [dominio pubblico]. Fonte: Wikimedia Commons. Nomenclatura
- Carbonato di potassio
- Carbonato di potassio
- Carbonato di dipotasium
- Potassa
- Sale di potassio dell'acido carbonico.
Proprietà
Stato fisico
Cristallino solido incolore al bianco.
Peso molecolare
138.205 g/mol.
Punto di fusione
899 ºC.
Punto di ebollizione
Si decompone.
Densità
2,29 g/cm3
Solubilità
Molto solubile in acqua: 111 g/100 g di acqua a 25 ° C. Insolubile in etanolo e acetone.
Può servirti: contributi dalla chimica alla medicinaph
Una soluzione acquosa può avere un pH di 11,6, cioè è abbastanza alcalino.
Proprietà chimiche
Il carbonato di potassio è unumo o igroscopico, cioè assorbe l'umidità dell'ambiente. Ha un idrato stabile, il k2Co3.2h2O.
Il k2Co3 In soluzione acquosa è idrolizzato, cioè reagisce con l'acqua rilasciando gruppi OH- che sono quelli che danno alcalinità alle soluzioni:
Co32- + H2O ⇔ oh- + HCO3-
HCO3- + H2O ⇔ oh- + H2Co3
Ottenimento
Può essere ottenuto dalle ceneri rimanenti quando si bruciano piante. Anche mediante carbonatazione di idrossido di potassio koh, ovvero aggiunta in eccesso di anidride carbonica co2 A koh:
KOH + CO2 → KHCO3
2 khco3 + calore → k2Co3 + H2O
Un altro modo per ottenerlo è riscaldare il cloruro di potassio KCL con carbonato di magnesio3, acqua e co2 sotto pressione. Un doppio magnesio idratato e sale di potassio e potassio si ottengono per primi3.Khco3.4h2Oppure, chiamato Engels Salt:
2 KCl + 3 MgCO3 + Co2 + 5 h2O → MgCO3.Khco3.4h2O ↓ + mgcl2
Il doppio sale idratato di Engels precipita e si separa dalla soluzione mediante filtrazione. Quindi il carbonato per auto di potassio viene riscaldato e formato2Co3 che aggiungendo acqua si dissolve mentre il carbonato di magnesio MGCO3 rimane insolubile ed eliminato dalla filtrazione.
Mgco3.Khco3.4h2O + calore → MgCO3↓ + 2 K+ + Co32- + Co2↑ + 9 h2O
Applicazioni
Nell'assorbimento di CO2 Nei processi industriali
La soluzione di carbonato di potassio è il trattamento classico per la rimozione di anidride carbonica Co2 In vari processi, specialmente nelle applicazioni ad alte pressioni e temperature.
 K soluzioni2Co3 Sono usati per assorbire co2 In vari processi industriali. Autore: Nicola Giordano. Fonte: Pixabay.
K soluzioni2Co3 Sono usati per assorbire co2 In vari processi industriali. Autore: Nicola Giordano. Fonte: Pixabay. La rimozione di CO2 si verifica secondo la seguente reazione:
K2Co3 + Co2 + H2O ⇔ 2 khco3
Questo metodo viene utilizzato ad esempio per trattare il gas naturale. Anche negli impianti di generazione di energia, per evitare l'emissione di CO2 all'atmosfera e nella produzione di ghiaccio secco.
Può servirti: idrossido di rame (ii): struttura, proprietà, nomenclatura, usi K soluzioni2Co3 Sono usati per ottenere CO2 che serve a preparare il ghiaccio secco. ProjectManhattan [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
K soluzioni2Co3 Sono usati per ottenere CO2 che serve a preparare il ghiaccio secco. ProjectManhattan [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. K -Solution2Co3 Può essere rigenerato termicamente, cioè a causa delle temperature riscaldate intorno a 100 ° C.
Affinché la soluzione di carbonato di potassio assorbi la CO2 a buona velocità, vengono aggiunti i promotori che accelerano il processo come la dietanolamina (DEA).
Nella rimozione di H2S di alcuni processi
Le soluzioni di carbonato di potassio vengono anche utilizzate per rimuovere il gas idrogeno solforato H2S di correnti di processo. A volte viene aggiunto il potassio tiffosphate k3Po4 Per rendere più veloce il processo.
Nei laboratori di chimica
Il k2Co3 consente la sintesi organica, ad esempio, nelle reazioni di condensa e per neutralizzare. Serve a rimuovere l'acqua dai fluidi organici, come agente disidratante o essiccante in laboratorio.
Viene anche utilizzato nelle reazioni di chimica analitica e in alcalizzare nell'industria farmaceutica.
Nel settore dei prodotti per la pulizia
Il k2Co3 Viene utilizzato per produrre sapone, formule per la pulizia, prodotti per abbigliamento e riciclaggio di piatti e anche per preparare shampoo e altri prodotti per la cura personale.
 Il k2Co3 È usato nella preparazione del sapone. Lacrosus [dominio pubblico]. Fonte: Wikimedia Commons.
Il k2Co3 È usato nella preparazione del sapone. Lacrosus [dominio pubblico]. Fonte: Wikimedia Commons. Nell'industria alimentare
Il carbonato di potassio viene aggiunto a vari alimenti con diversi scopi.
Ad esempio, viene aggiunto ai semi di cacao per eliminare il loro gusto amaro e usarli nella produzione di cioccolato. Viene aggiunto all'uva nel processo di essiccazione per ottenere uve raisidiche.
 I semi di cacao sono trattati con k2Co3 Per ridurre il suo gusto amaro quando si prepara il cioccolato. Autore: Magali Course. Fonte: Pixabay.
I semi di cacao sono trattati con k2Co3 Per ridurre il suo gusto amaro quando si prepara il cioccolato. Autore: Magali Course. Fonte: Pixabay. In pasticceria è usato come leudante (fungendo da lievito) della farina per preparare cibi cotti.
Può servirti: Lutecio: struttura, proprietà, usi, ottenendo Il k2Co3 Può essere usato come ledant in torte perché quando emette CO2 Durante la cottura questi aumentano il volume. Autore: pixel1. Fonte: Pixabay.com
Il k2Co3 Può essere usato come ledant in torte perché quando emette CO2 Durante la cottura questi aumentano il volume. Autore: pixel1. Fonte: Pixabay.com Nei fertilizzanti
Il k2Co3 Viene utilizzato per fertilizzare i terreni acidi, come il carbone co -co32- In contatto con l'acqua produce ioni OH- che aumentano il pH del terreno. Oltre al potassio k+ È un nutriente per le piante.
Il carbonato di potassio è stato anche utilizzato per produrre fertilizzanti a lento rilascio.
Un fertilizzante a rilascio lento rilascia o nutrienti sciolti in modo che non vengano sciolti e trascinati dall'acqua. Grazie a questo, possono trascorrere più tempo disponibili per le radici delle piante.
In diverse applicazioni
Carbonato di potassio k2Co3 È usato anche per:
- Processi di pulizia della lana di asciugatura, sbiancati e puliti e altre attività del settore tessile
- Ottenere altri sali di potassio organici e inorganici, come il cianide di potassio KCN.
- Funzionare come regolatore di acidità in vari processi.
- Fare ceramica e ceramica.
- Processi di incisione e litografia.
- Tan.
- Preparare inchiostri di stampa, pigmenti.
- Vetro di manufacce2Co3 È più compatibile di quello di navigatore di sodio Na2Co3 Con piombo, bario e ossidi di stronzio che questi vetri contengono.
- Trattamento delle acque.
- Ritardare il fuoco (sotto forma di soluzioni acquose).
- Inibire la corrosione e come agente anti-cura nei team di processo.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Carbonato di potassio. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Steele, d. (1966). La chimica degli elementi metallici. Pergamon Press Ltd. Londra.
- Mokhatab, s. et al. (2019). Trattamento del gas naturale. La soluzione di carbonato di potassio. Nel manuale di trasmissione e lavorazione del gas naturale (quarta edizione). Recuperato da ScienceDirect.com.
- Kakaras, e. et al. (2012). Sistemi di ciclo combinati a letto fluidizzato in pressione (PFBC). Combustazione a letto fluidizzato pressurizzato con cattura e conservazione del carbonio. Nei sistemi di ciclo combinati per la generazione di energia di emissione quasi zero. Recuperato da ScienceDirect.com.
- Speight, j.G. (2019). Produzione di idrogeno. Sfruttamento bagnato. In pesante recupero e aggiornamento del petrolio. Recuperato da ScienceDirect.com.
- Branan, c.R. (2005). Trattamento del gas: capitolo aggiornato di Chris Higman. Processo di carbonato caldo. In Regole empirica per gli ingegneri chimici (quarta edizione). Recuperato da ScienceDirect.com.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Quarta edizione. John Wiley & Sons.
- L'enciclopedia di chimica industriale di Ullmann. (1990). Quinta edizione. VCH Verlagsgellschaft MBH.
- Li, e. e Cheng, F. (2016). Sintesi di un nuovo fertilizzante di potassio a rilascio lento da scorie di magnesio Pidgeon modificato mediante carbonato di potassio. J Air Waste Manag Assoc, 2016 agosto; 66 (8): 758-67. NCBI recuperato.Nlm.NIH.Gov.
- « Concetto di decantazione, esempi e tipi
- Caratteristiche tedesche di scarafaggio, riproduzione, cibo »

