Strato Valencia
- 1952
- 195
- Cosetta Messina
 Lo strato di Valencia è dove si verificano reazioni chimiche
Lo strato di Valencia è dove si verificano reazioni chimiche Qual è lo strato di Valencia?
IL Strato Valencia È quello i cui elettroni sono responsabili delle proprietà chimiche di un elemento. Gli elettroni in questo strato interagiscono con quelli di un atomo vicino, per formare legami covalenti (A-B); E se emigrano da un atomo a un altro collegamenti ionici più elettronegativi (A+B-).
Questo strato è definito dal numero quantico principale N, che a sua volta indica il periodo in cui l'elemento si trova nella tabella periodica. Mentre l'ordinamento da parte dei gruppi dipende dal numero di elettroni in orbita nello strato di Valencia.
Così per a N uguale a 2, puoi occupare otto elettroni: otto gruppi (1-8).
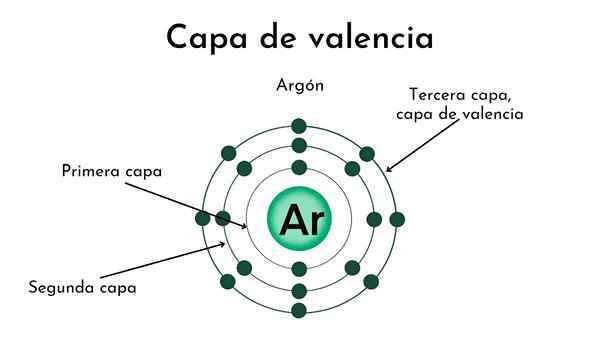
 Nucleo di un atomo con quattro strati. Fonte: Gabriel Bolívar
Nucleo di un atomo con quattro strati. Fonte: Gabriel Bolívar Nell'immagine superiore e nella copertura è illustrato il significato dello strato di Valencia. Il punto nero al centro dell'atomo è il nucleo, mentre i restanti cerchi concentrici sono gli strati elettronici definiti da N.
Quanti strati ha questo atomo? Ognuno di loro ha il suo colore e quando ce ne sono quattro, allora l'atomo ha quattro strati (N= 4).
Si noti che il colore è degradante man mano che la distanza dallo strato aumenta al nucleo. Lo strato di Valencia è quello che è più lontano dal nucleo: il colore più chiaro.
Qual è lo strato di Valencia?
Secondo l'immagine, lo strato di Valencia non è altro che gli ultimi orbitali di un atomo occupato dagli elettroni. Nello strato azzurro, per N= 4 Esistono una serie di orbitali 4s, 4p, 4d e 4f; cioè, all'interno ci sono altre sottocampanie con diverse capacità elettroniche.
Un atomo ha bisogno di elettroni per riempire tutti gli orbitali 4n. Questo processo può essere osservato nelle configurazioni elettroniche degli elementi per un periodo.
Può servirti: alcani lineari: struttura, proprietà, nomenclatura, esempiAd esempio, il potassio ha una configurazione elettronica [AR] 4s1, Mentre il calcio, alla tua destra, [ar] 4s2.
Secondo queste configurazioni, qual è il livello Valencia? Il termine [AR] si riferisce alla configurazione elettronica di Noble Argon 1s Gas22s22 p63s23p6. Questo rappresenta lo strato interno o chiuso (che è anche noto come Kernel).
Poiché l'orbitale 4S è quello con la massima energia e in cui entrano i nuovi elettroni, rappresenta lo strato di valenza sia per K che per la CA. Se gli atomi di K e CA fossero confrontati con quello dell'immagine, [AR] sarebbe tutti gli strati interni di blu; e 4s lo strato azzurro, l'esterno.
Caratteristiche dello strato di Valencia
Da quanto sopra, alcune caratteristiche dello strato di Valencia possono essere riassunte per tutti gli atomi:
-Il suo livello di energia è più alto; Ciò che è lo stesso, è più ritirato dal nucleo e ha la densità elettronica più bassa (rispetto ad altri strati).
-È incompleto. Pertanto, continuerà ad essere riempito con elettroni in quanto un periodo da sinistra a destra è in viaggio nella tavola periodica.
-Interviene nella formazione di collegamenti covalenti o ionici.
Nel caso di metalli di potassio e calcio, si ossidano per trasformarsi in cationi. Il k+ Ha una configurazione elettronica [AR], perché perde il suo solo elettrone esterno 4S1. E sul lato della CA2+, La sua configurazione è anche [AR]; Perché invece di perdere un elettrone, perde due (4s2).
Ma qual è la differenza tra K+ e il ca2+, Se entrambi perdono gli elettroni del loro strato di valenza e hanno una configurazione elettronica [AR]? La differenza è nelle sue radio ionici.
Può servirti: ossido di mercurio (HG2O)AC2+ è più piccolo di k+ Perché l'atomo di calcio ha un protone aggiuntivo che attira elettroni esterni (chiuso o Valencia) più forza).
Lo strato di Valencia 4S non è scomparso: è vuoto solo per questi ioni.
Esempi di livello di Valencia
Il concetto di strato di Valencia può essere direttamente o indirettamente in molti aspetti della chimica.
Perché i loro elettroni sono quelli che partecipano alla formazione di obbligazioni, qualsiasi argomento che li affronta (TEV, RPECV, meccanismi di reazione, ecc.) Devi fare riferimento a detto livello.
Questo perché, più importanti dello strato di valenza, sono i suoi elettroni, chiamati elettroni Valencia. Quando rappresentano la costruzione progressiva di configurazioni elettroniche, definiscono la struttura elettronica dell'atomo e, quindi, le sue proprietà chimiche.
Da queste informazioni da un atomo A e un altro B, le strutture dei loro composti possono essere schierate attraverso le strutture di Lewis. Allo stesso modo, le strutture elettroniche e molecolari di una gamma di composti possono essere determinate grazie al numero di elettroni di valenza.
Gli esempi possibili e più semplici di strati di valenza sono nella tabella periodica; In particolare, in configurazioni elettroniche.
Esempio 1
È possibile identificare un elemento e la sua posizione nella tabella periodica solo con configurazione elettronica. Pertanto, se un elemento x ha configurazione [kr] 5s25 p1, Di cosa si tratta e di quale periodo e gruppo appartengano?
dato che N= 5, x è nel quinto periodo. Inoltre, ha tre elettroni di Valencia: due nell'orbitale 5S2 E uno in 5p1. Il livello interiore [KR] non fornisce maggiori informazioni.
Può servirti: acido bromidrico (HBR)Poiché X ha tre elettroni e i suoi orbitali 5p sono incompleti, è nel blocco P; Inoltre, nel Gruppo IIIA (romanico) o 13 (sistema di numerazione corrente da parte dell'IUPAC). X è quindi l'elemento indiano, in.
Esempio 2
Qual è l'elemento x con configurazione elettronica [kr] 4d105s1? Nota che come l'in -in, appartiene al periodo 5, dal momento che l'orbitale 5S1 è la maggior parte dell'energia. Tuttavia, lo strato di Valencia include anche gli orbitali 4D, poiché lo sono incompleto.
Gli strati di Valencia possono quindi essere designati come NSNP, per un elemento del blocco P o S; o (n-1) DNS, per un elemento di blocco d. In modo che l'elemento misterioso X appartiene al blocco D perché la sua configurazione elettronica è del tipo DNS (N-1) (4D105s1).
Quale gruppo appartiene? Aggiunta dei dieci elettroni dell'orbitale 4D10, e uno dei 5 secondi1, X ha undici elettroni da Valencia. Pertanto, deve trovarsi nel gruppo Ib U 11. Quindi viaggiando attraverso il periodo 5 della tavola periodica fino a quando il gruppo 11 raggiungi l'elemento d'argento, AG.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica (quarta edizione, p. 23). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. Chimica (8a ed.). Cengage Learning, P. 287.
- NDT Resource Center (S.F.). Il guscio di valenza. Preso da: nde-ed.org
- Clackamas Community College (2002). Elettroni di valenza. Estratto da: DL.Clackama.Edu
- Chimica librettext (s.F.). Valenza e elettroni core. Recuperato da: Chem.Librettexts.org

