Buteno

- 4735
- 1385
- Rufo Longo
 Struttura chimica del buutene
Struttura chimica del buutene Qual è il buteno?
Lui Buteno È il nome che riceve una serie di quattro isomeri con formula chimica C4H8. Sono alcheni o olefine, cioè hanno un doppio legame c = c nella loro struttura. Inoltre, sono idrocarburi, che possono essere trovati nei depositi di olio o originati da cracking termici e ottenendo prodotti a basso peso molecolare.
I quattro isomeri reagiscono con l'ossigeno che rilasciano calore e una fiamma gialla. Possono anche reagire con un ampio spettro di piccole molecole che vengono aggiunte al loro doppio legame.
Ma quali sono gli isomeri del buteno? Nell'immagine superiore, la struttura con sfere bianche (idrogeni) e neri (carboni) è rappresentata per il 1-butene. Il 1-butene è l'isomero più semplice di idrocarburi c4H8.
Si noti che ci sono otto sfere bianche e quattro sfere nere, che sono d'accordo con la formula chimica.
Gli altri tre isomeri sono cis e trans 2-butene e iso-butene. Tutti mostrano proprietà chimiche molto simili, sebbene le loro strutture causino variazioni nelle proprietà fisiche (fusion e punti di ebollizione, densità, ecc.).
Inoltre, i loro spettri IR hanno modelli simili di bande di assorbimento.
Colloquialmente, 1-butene è chiamato buteno, sebbene 1-butene si riferisca solo a un singolo isomero e non a un nome generico. Questi quattro composti organici sono gas, ma possono essere liquefatti ad alte pressioni o condens.
Sono una fonte di calore ed energia, reagenti per la sintesi di altri composti organici e, soprattutto, necessari per la produzione di gomma artificiale dopo la sintesi del butadiene.
Proprietà fisiche e chimiche di Buteno
Peso molecolare
56.106 g/mol. Questo peso è lo stesso per tutti gli isomeri della formula C4H8.
Aspetti fisici
È un gas incolore e infiammabile (come gli altri isomeri) e ha un odore relativamente aromatico.
Punto di ebollizione
I punti di ebollizione per gli isomeri di Buteno sono i seguenti:
1 -butene: -6º C
Cis-2-butene: 3.7 ° c
Trans-2-butene: 0.96º c
2 -metilpropene: -6.9º c
Punto di fusione
1 -butene: -185.3 ° c
Cis-2-butene: -138.9º c
Trans-2-Butene: -105.5 ° c
2 -metilpropeno: -140.4 ° c
Solubilità
Buteno è molto insolubile in acqua a causa della sua natura apolare. Tuttavia, si dissolve perfettamente in alcuni alcoli, come benzene, toluene ed eteri.
Densità
0.Da 577 a 25º C. Pertanto, è meno denso dell'acqua e in un contenitore si troverebbe sopra lo stesso.
Reattività
Come ogni alchene, il suo doppio legame è suscettibile all'aggiunta di molecole o ossidando. Questo rende reattivi il buteno e i suoi isomeri. D'altra parte, sono sostanze infiammabili, quindi prima di un eccesso di temperatura reagiscono con l'ossigeno dell'aria.
Può servirti: bulanal: struttura, proprietà, usi e rischiStruttura chimica del buutene
Nell'immagine superiore è rappresentata la struttura del 1-butene. Alla tua sinistra puoi vedere la posizione del doppio legame tra il primo e il secondo carbonio.
La molecola ha una struttura lineare, sebbene la regione attorno al collegamento C = C sia piatta a causa dell'ibridazione SP2 di questi carboni.
Se la molecola 1-butene fosse girata ad un angolo di 180º, la stessa molecola non avrebbe cambiamenti apparenti, quindi manca di attività ottica.
Come interagirebbero le tue molecole? I collegamenti C-H, C e C-C sono la natura apolare, quindi nessuno di loro collabora nella formazione di un momento di dipolo.
Di conseguenza, molecole CHO2= Chch2Cap3 Devono interagire attraverso le forze di dispersione di Londra.
L'estremità destra del butene forma dipolo istantaneo, che a breve distanza polarizza gli atomi adiacenti di una molecola vicina. D'altra parte, l'estremità sinistra del collegamento C = C, interagisce le nuvole π sopra l'altra (come due wafer o fogli).
Poiché ci sono quattro atomi di carbonio che compongono lo scheletro molecolare, le sue interazioni non sono abbastanza sufficienti per la fase liquida per avere un punto di ebollizione di -6º C.
Isomeri costituzionali e geometrici
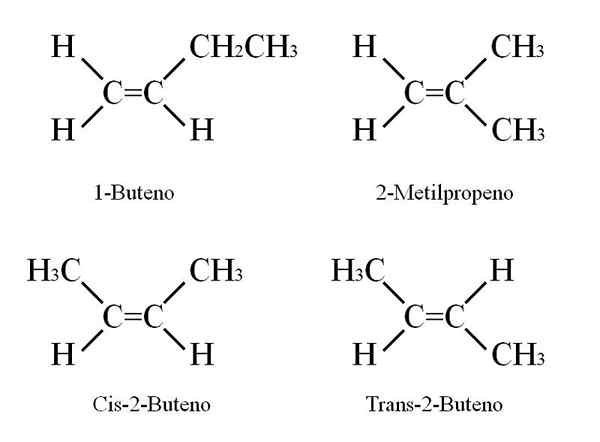 Strutture butine. Fonte: Gabriel Bolívar
Strutture butine. Fonte: Gabriel Bolívar Il 1-butene ha una formula molecolare C4H8; Tuttavia, altri composti possono avere nella loro struttura la stessa proporzione di atomi di C e H.
Come è possibile? Se la struttura del 1-butene è osservata attentamente, i sostituenti di carboni c = c possono essere scambiati. Questo scambio produce altri composti dallo stesso scheletro.
Inoltre, la posizione a doppio legame tra C-1 e C-2 può spostarsi verso C-2 e C-3: CH3Ch = chch3, 2-butene.
Nel 2-butene, gli atomi H possono essere posizionati sullo stesso lato del doppio legame, che corrisponde allo stereoisomero cis; o in un orientamento spaziale opposto, nel trans stereoisomero. Entrambi costituiscono ciò che è anche noto come isomeri geometrici. Lo stesso vale per i gruppi -CH3.
Allo stesso modo, si noti che se lasciato nella molecola di Cho3Ch = chch3 Gli atomi H da un lato e i gruppi CH3 In un altro, verrebbe ottenuto un isomero costituzionale: CH2= C (CH3)2, 2-metilpropene (noto anche come iso-butene).
Può servirti: nitrato di potassio (KNO3)Questi quattro composti hanno la stessa formula C4H8 Ma strutture diverse. 1-butene e 2-metilpropene sono isomeri costituzionali; e cis e trans-2-butene, isomeri geometrici tra loro due (e costituzionali rispetto al resto).
Stabilità
Calore a combustione
Dall'immagine superiore, quale dei quattro isomeri rappresenta la struttura più stabile? La risposta può essere trovata, ad esempio, nei calo di combustione di ciascuno di essi.
Quando reagi con ossigeno, l'isomero con la formula C4H8 si trasforma in CO2 Rilasciare acqua e calore:
C4H8(g) + 6o2(g) => 4co2(g) + 4h2O (g)
La combustione è esotermica, quindi più calore viene rilasciato, più instabile è l'idrocarburo. Pertanto, quello dei quattro isomeri che rilascia meno calore da bruciare in aria, sarà il più stabile.
I calo della combustione per i quattro isomeri sono:
-1-butene: 2717 kJ/mol
-Cis-2-butene: 2710 kJ/mol
-Trans-2-Butene: 2707 KJ/mol
-2-metilpropeno: 2700 kJ/mol
Si noti che il 2-metilpropene è l'isomero che emette meno calore. Mentre 1-butene è quello che rilascia il maggior numero di calore, che si traduce in una maggiore instabilità.
Effetto sterico ed elettronico
Questa differenza di stabilità tra gli isomeri può essere detratta direttamente dalla struttura chimica.
Secondo gli alcheni, quello che possiede più sostituenti R acquisisce una maggiore stabilizzazione del suo doppio legame. Pertanto, il 1-butene è il più instabile perché ha a malapena un sostituente (-Ch2Cap3); Cioè, è monosustuido (RHC = Cho2).
Gli isomeri cis e trans del 2-butene differiscono in energia a causa della tensione della parete di van der originata dall'effetto sterico.
Nell'isomero cis, i due gruppi CH3 Sullo stesso lato del doppio legame si respingono a vicenda, mentre nell'isomero trans, questi sono sufficientemente remoti l'uno dall'altro.
Ma perché allora il 2-metilpropene è l'isomero più stabile? Perché l'effetto elettronico intercede.
In questo caso, sebbene sia un alchene disciolto, i due gruppi CH3 Sono nello stesso carbonio; in una posizione geminale riguardante l'altra.
Questi gruppi stabilizzano il carbonio a doppio legame dandogli parte della loro nuvola elettronica (poiché è relativamente più acido avendo ibridazione SP2).
Inoltre, nel 2-butene i suoi due isomeri hanno solo 2 ° carboni; Mentre il 2-metilpropene contiene un terzo carbonio, di maggiore stabilità elettronica.
Può servirti: struttura dei materiali: concetto ed esempiForze intermolecolari
La stabilità dei quattro isomeri segue un ordine logico, ma lo stesso non accade con le forze intermolecolari. Se vengono confrontati i loro punti di scioglimento e ebollizione, scopriranno che non obbediscono allo stesso ordine.
Ci si aspetta che il trans-2-butene presenti le più grandi forze intermolecolari per avere un maggiore contatto superficiale tra due molecole, a differenza del CIS-2-butene, il cui scheletro disegna un C. Tuttavia, il cis-2-butene bolle a una temperatura più elevata (3.7 ° c), che il trans isomero (0.96º C).
I punti di ebollizione simili per 1-butene e 2-metilpropene li aspetterebbero perché sono strutturalmente molto simili. Tuttavia, nello stato solido la differenza cambia radicalmente. Il 1 -butene si scioglie a -185.3º C, mentre il 2 -metilpropene a -140.4 ° c.
Inoltre, l'isomero CIS-2-butene si scioglie a -138.9º C, a una temperatura molto vicina a 2-metilpropene, il che può significare che nel solido hanno una disposizione altrettanto stabile.
Da questi dati si può concludere che, nonostante conosca le strutture più stabili, non fanno abbastanza luce nella conoscenza di come funzionano le forze intermolecolari nel liquido; E ancora di più, nella fase solida di questi isomeri.
Butenus usa
-I buteniani, data il loro calore di combustione, possono semplicemente essere usati come fonte di calore o carburante. Pertanto, ci si aspetterebbe che la fiamma di 1-butene è più calda di quella degli altri isomeri.
-Possono essere usati come solventi organici.
-Servono da additivi per aumentare il livello di ottano di benzina.
-All'interno della sintesi organica, il 1-butene partecipa alla produzione di altri composti come: ossido di butilene, 2-glutanolo, succinimida e terbutilmecaptano (usato per dare al gas della cucina il suo odore caratteristico).
Inoltre, dagli isomeri Butene puoi ottenere Butadieno (Cho2= CH-CH = CH2), di cui viene sintetizzata la gomma artificiale.
Oltre a questa sintesi, la diversità dei prodotti dipenderà da quali molecole vengono aggiunte al doppio legame.
Ad esempio, gli alogenuri alchilici possono essere sintetizzati se vengono reagiti con alogeni; alcoli, se aggiungono acqua in un mezzo acido; e terzi butleres se aggiungono alcoli a basso peso molecolare (come il metanolo).
Riferimenti
- Francis a. Tartaruga. Chimica organica. Acidi carbossilici (sesta edizione, pagina 863-866). Mc Graw Hill.
- Wikipedia (2018). Buteno. Tratto da: è.Wikipedia.org
- YPF (luglio). Buteniani. [PDF]. Preso da: YPF.com
- William Reusch (2013). Reazioni di aggiunta degli elenchi. Recuperato da: 2.Chimica.MSU.Edu
- PUBCHEM (2018). 1-butene. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov

