Bromo storia, struttura, configurazione elettronica, proprietà, usi

- 2039
- 102
- Baldassarre Ross
Lui bromo È un elemento non metallico che appartiene al gruppo Halogens, Gruppo 17 (VIIA) della tabella periodica. Il suo simbolo chimico è il BR. È presentato come una molecola diatomica, i cui atomi sono uniti da un legame covalente, quindi la formula molecolare è assegnata2.
A differenza del fluoro e del cloro, il bromo in condizioni terrestri non è un gas ma un liquido marrone rossastro (immagine inferiore). Sta fumando ed è insieme al mercurio, gli unici elementi liquidi. Sotto di esso, lo iodio, sebbene il suo colore si intensi e diventa viola, può cristallizzare in un solido volatile.
 Fialta con bromo liquido puro. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]
Fialta con bromo liquido puro. Fonte: immagini ad alta risoluzione degli elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] Il Bromo fu scoperto, indipendentemente, nel 1825 da Carl Löwig, che studiò sotto la direzione del chimico tedesco Leopold Gmelin; E nel 1826, dal chimico francese Antoine-jerome Ballard. Tuttavia, la pubblicazione dei risultati sperimentali di Balard ha preceduto quello di Löwig.
Bromo è il 62 ° elemento più abbondante sulla terra, distribuito a basse concentrazioni dalla corteccia terrestre. Nel mare, la concentrazione media è di 65 ppm. Il corpo umano contiene un bromo allo 0,0004 %, non conoscendo definitivamente la sua funzione.
Questo elemento è sfruttato commercialmente nelle Salmuelas o nei luoghi che per condizioni speciali sono sali alti; Ad esempio, il Mar Morto, a cui convergono le acque dei Territori vicini.
È un elemento corrosivo in grado di attaccare i metalli, come il platino e il paladio. Sciolto in acqua, il bromo può anche esercitare la sua azione corrosiva sui tessuti umani, aggravando la situazione perché l'acido bromoriterico può essere generato. Per quanto riguarda la sua tossicità, può causare danni importanti agli organi, come fegato, reni, polmoni e stomaco.
Il bromo è molto dannoso nell'atmosfera, essendo 40-100 volte più distruttivo per lo strato di ozono rispetto al cloro. La metà della perdita dello strato di ozono in Antartide è prodotta da reazioni correlate al bromometil, il composto usato come fumigante.
Ha numerosi usi, ad esempio: ignifugo, agente sbiancante, disinfettante di superficie, additivo al combustibile, intermediario nella produzione sedativa, nella produzione di sostanze chimiche organiche, ecc.
[TOC]
Storia
Carl Löwig Work
Il bromo fu scoperto in modo indipendente e quasi contemporaneamente da Carl Jacob Löwig, un chimico tedesco nel 1825, e da Antoine Balard, un chimico francese nel 1826.
Carl Löwig, discepolo del chimico tedesco Leopold Gmelin, raccolse acqua da una primavera di cattivo Kreuznach e aggiunse cloro; Dopo l'aggiunta dell'etere, ha suscitato la miscela di liquidi.
Quindi, l'etere separato dalla distillazione e lo concentrò per evaporazione. Di conseguenza, ottenne una sostanza marrone rossastra, che era il bromo.
Antoine Balard Work
Balard, d'altra parte, ha usato le ceneri di un'alga marrone. Così il bromo rilasciato, il cloro passò attraverso il materiale acquoso sottoposto a estrazione, in cui era presente il bromuro di magnesio, MGBR2.
Successivamente, il materiale è stato distillato in presenza di biossido di manganese e acido solforico, producendo vapori rossi che si sono condensati in un liquido scuro. Balard pensava che fosse un nuovo elemento e lo chiamava Muride, derivato dalla parola latina Muria, con la quale era designata la salamoia.
Può servirti: Living Matter: concetto, caratteristiche ed esempiÈ stato sottolineato che Balard ha cambiato il nome di Muride in Brôme per suggerimento di Anglada o Gay-Lussac, in base al fatto che Brôme significa pestilente, che definisce l'odore dell'elemento scoperto.
I risultati sono stati pubblicati da Belard in Annales di Chemie and Physice, prima che Löwig pubblicasse il suo.
Solo dal 1858, il bromo fu prodotto in quantità importanti; anno in cui sono stati scoperti e sfruttati i depositi di sale di stassfurt, ottenendo il bromo.
Struttura e configurazione elettronica Bromo
Molecola
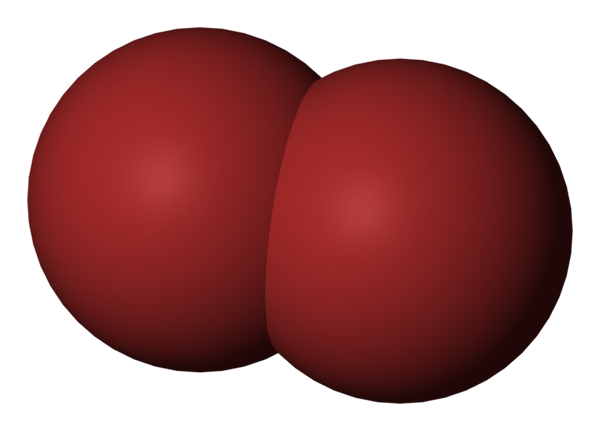 Molecola BR2. Fonte: Benjah-BMM27 [dominio pubblico].
Molecola BR2. Fonte: Benjah-BMM27 [dominio pubblico]. Nell'immagine superiore viene mostrata la molecola di bromo, BR2, Con un modello di riempimento compatto. In realtà, esiste un semplice legame covalente tra i due atomi di bromo, BR-BR.
Essendo una molecola diatomica e omogenea, manca di un momento di dipolo permanente e può interagire solo con gli altri dello stesso tipo attraverso le forze di dispersione di Londra.
Questo è il motivo per cui il tuo liquido rossastro sta fumando; Nelle molecole BR2, Mentre sono relativamente pesanti, le loro forze intermolecolari le mantengono debolmente collegate.
Bromo è meno elettronegativo del cloro e quindi esercita un effetto di attrazione inferiore sugli elettroni degli strati di Valencia. Di conseguenza, richiede meno energia per percorrere livelli di energia più elevati, assorbendo fotoni verdi e riflettendo un colore rossastro.
Cristalli
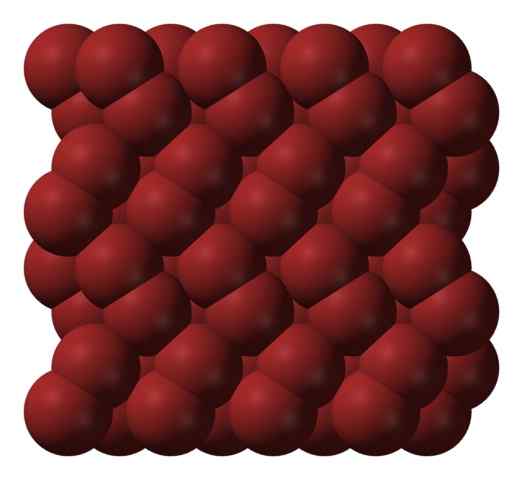 Struttura cristallina bromo. Fonte: Ben Mills [dominio pubblico].
Struttura cristallina bromo. Fonte: Ben Mills [dominio pubblico]. In una fase gassosa, molecole BR2 Si separano considerevolmente fino a quando non ci sono interazioni efficienti tra di loro. Tuttavia, al di sotto del suo punto di fusione, il bromo può essere congelato in cristalli ortorombici rossastri (immagine superiore).
Nota come le molecole BR2 Sono posizionati ordinati in modo tale da sembrare "vermi di bromo". Qui e a queste temperature (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
STANGE Valencia e stati di ossidazione
La configurazione di bromo elettronico è:
[AR] 3D104s2 4p5
Essere 3d104s2 4p5 il suo strato di valenza (sebbene l'orbitale 3D10 Non avere importanza nelle tue reazioni chimiche). Gli elettroni degli orbitali 4s e 4p sono i più esterni e aggiungono un totale di 7, un solo elettrone per completare l'ettetto di Valencia.
Da questa configurazione i possibili stati di ossidazione possono essere dedotti per il bromo: -1, se un elettrone guadagna da isolettronico al Kripton; +1, essere come 3d104s2 4p4; +3, +4 e +5, perdendo tutti gli elettroni dell'orbitale 4p ([AR] 3D104s24p0); e +7, correndo senza elettroni nell'orbitale 4S ([AR] 3D104s04p0).
Proprietà
Aspetto fisico
Piccolo liquido rossastro marrone scuro. Si trova in natura come una molecola diatomica, con atomi uniti da un legame covalente. Bromo è un liquido più denso dell'acqua e ci affonda.
Può servirti: radio: struttura, proprietà, usi, ottenimentoPeso atomico
79.904 g/mol.
Numero atomico
35.
Odore
Un fumo acro, soffocante e irritante.
Punto di fusione
-7,2 ºC.
Punto di ebollizione
58,8 ºC.
Densità (Br2) liquido
3.1028 g/cm3
Solubilità dell'acqua
33,6 g/l a 25 ° C. La solubilità del bromo in acqua è bassa e tende ad aumentare diminuendo la temperatura; comportamento simile ad altri gas.
Solubilità
Liberamente solubile in alcol, etere, cloroformio, tetracloruro di carbonio, disolfuro di carbonio e acido cloridrico concentrato. Solubile in solventi non polari e alcuni polari come alcol, acido solforico e in molti solventi alogenati.
Triplo punto
265,9 K a 5,8 kPa.
Punto critico
588 K a 10,34 MPa.
Calore di fusione (BR2)
10.571 kJ/mol.
Calore di vaporizzazione (BR2)
29,96 kJ/mol.
Capacità calorica molare (BR2)
75,69 kJ/mol.
Pressione del vapore
A una temperatura di 270 K, 10 kPa.
Temperatura di auto -Identizione
Non infiammabile.
punto di accensione
113 ºC.
Temperatura di conservazione
Da 2 a 8 ºC.
Tensione superficiale
40,9 mn/m a 25 ºC.
Soglia di odore
0,05 - 3,5 ppm. 0,39 mg/m3
Indice di rifrazione (ηd)
Da 1.6083 a 20 ºC e da 1.6478 a 25 ºC.
Elettronegatività
2.96 su scala pauling.
Energia ionizzata
- Primo livello: 1.139,9 kJ/mol.
- Secondo livello: 2.103 kJ/mol.
- Terzo livello: 3.470 kJ/mol.
Radio atomica
120 pm.
Radio covalente
120.3 pm.
Van der Waals Radio
185 pm.
Reattività
È meno reattivo del cloro, ma più reattivo dello iodio. È un ossidante meno forte del cloro e più forte dello iodio. È anche un agente riducente più debole dello iodio, ma più forte del cloro.
Il vapore di cloro è altamente corrosivo per molti materiali e tessuti umani. Attacca molti elementi metallici, tra cui platino e paladio; Ma non attacca il piombo, il nichel, il magnesio, il ferro, lo zinco e meno di 300 ºC al sodio.
Bromo in the Water sperimenta un cambiamento e si trasforma in bromuro. Può esistere anche come bromato (fratello3-), A seconda del pH liquido.
A causa della sua azione ossidante, il bromo può indurre il rilascio di radicali senza ossigeno. Questi sono forti ossidanti e possono causare danni ai tessuti. Inoltre, il bromo può produrre accensione spontanea se combinato con potassio, fosforo o stagno.
Applicazioni
Additivo per benzina
Il dibromuro di etilene è stato usato per eliminare possibili depositi di piombo nei motori delle auto. Dopo la combustione della benzina, che utilizzava il piombo come additivo, il bromo combinato con il piombo al piombo bromuro, un gas volatile espulso dal tubo di scarico.
Mentre il bromo ha eliminato il piombo dalla benzina, la sua azione distruttiva sullo strato di ozono era molto potente, motivo per cui è stato scartato per questa applicazione.
Pesticidi
Il bromuro di metilene o bromometil è stato usato come pesticida per purificare i terreni, in particolare per eliminare i nematodi parassiti, come ogni lostoma.
Tuttavia, l'uso della maggior parte dei composti contenenti bromo è stato scartato, ancora una volta, distruttivo sullo strato di ozono.
Controllo dell'emissione di mercurio
Bromo è usato in alcune piante per ridurre l'emissione di mercurio, metallo molto tossico.
Può servirti: gravimetria: analisi gravimetrica, metodi, usi ed esempiFotografia
Il bromuro d'argento, oltre allo yoduro d'argento e al cloruro d'argento, è usato come composto sensibile alla luce nelle emulsioni fotografiche.
Azioni terapeutiche
Il bromuro di potassio, così come il bromuro di litio, furono usati come sedativi generali nel XIX secolo e all'inizio del ventesimo secolo. I sali semplici sono ancora usati in alcuni paesi come le anticonvulsioni.
Tuttavia, la FDA degli Stati Uniti non approva l'uso del bromo per il trattamento di qualsiasi malattia oggi.
Ritardatore di fuoco
Il bromo viene trasformato dalle fiamme in acido bromorico, che interferisce con la reazione di ossidazione che si verifica durante il fuoco e produce la sua estinzione. I polimeri contengono bromo sono usati per produrre resine per ritardare l'incendio.
Additivo alimentare
Sono state aggiunte tracce di bromato di potassio alla farina per migliorare la sua cottura.
Reagenti chimici e intermediario
Il bromuro di idrogeno è usato come agente riducente e catalizzatore per le reazioni organiche. Bromo è usato come intermediario chimico nella produzione di farmaci, fluidi idraulici, agenti del refrigerante, deumidificatori e preparati per ondulare i capelli.
Trova inoltre l'uso nell'elaborazione di fluidi di perforazione, prodotti per la disinfezione dell'acqua, agenti bianchi, disinfettanti di superficie, coloranti, additivi per il carburante, ecc.
Azione biologica
Uno studio condotto nel 2014 indica che il bromo è un cofattore necessario per la biosintesi del collagene IV, che rende il bromino un elemento essenziale per lo sviluppo dei tessuti animali. Tuttavia, non ci sono informazioni sulle conseguenze di un deficit dell'elemento.
Dove si trova
Bromo viene estratto commercialmente da miniere di sale e pozzi di salmuelas profondi trovati nello stato dell'Arkansas, e nel grande lago salato dello Utah, entrambi negli Stati Uniti. Quest'ultima salamoia ha una concentrazione di bromo dello 0,5 %.
Per estrarre il bromo.
Il Mar Morto, al confine tra Giordania e Israele, è un mare chiuso che è sotto il livello del mare, il che lo rende una concentrazione molto elevata di sali.
Bromo e Potassa sono ottenuti commercialmente lì, per evaporazione dell'acqua con un alto sale del Mar Morto. In questo mare la concentrazione di bromo può raggiungere 5 g/l.
Si trova anche in alte concentrazioni in alcune sorgenti calde. La Bomita, per esempio, è un minerale di bromuro d'argento trovato in Bolivia e Messico.
Rischi
Il bromo in stato liquido è corrosivo per i tessuti umani. Ma il più grande pericolo per l'uomo viene da vapori di bromo e inalazione.
Respirare in un ambiente con una concentrazione di bromo di 11-23 mg/m3 Produce gravi shock. Una concentrazione di 30-60 mg/m3 È estremamente dannoso. Nel frattempo, una concentrazione di 200 mg può essere fatale.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Bromo. Database PubChem. CID = 23968. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Ross Rachel. (8 febbraio 2017). Fatti sul bromo. Recuperato da: LiveScience.com
- Wikipedia. (2019). Borace. Recuperato da: in.Wikipedia.org
- Lentech b. V. (2019). Bromo. Recuperato da: lentech.com
- « Caratteristiche, struttura, tipi e funzione della miosina
- Caratteristiche, struttura, tipi e funzioni delle nucleas »

