Caratteristiche, struttura, tipi e funzione della miosina
- 1530
- 31
- Rosolino Santoro
IL Miosina È un motore molecolare, di natura proteica, in grado di muoversi sui filamenti di actina nel citosol. L'energia che guida lo spostamento della miosina proviene dall'idrolisi ATP. Per questo motivo, la miosina è di solito definita come un enzima mecanochimico.
Negli eucarioti, la miosina è una proteina molto abbondante. Esistono diversi tipi di miosina, che sono codificati da una famiglia di geni. Nei lieviti si distinguono 5 classi, mentre dozzine sono state descritte nei mammiferi.
 Fonte: David Richfield (Utente: Slashme) Quando si utilizza questa immagine in opere esterne, può essere citata come segue: Richfield, David (2014). "Galleria medica di David Richfield". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]
Fonte: David Richfield (Utente: Slashme) Quando si utilizza questa immagine in opere esterne, può essere citata come segue: Richfield, David (2014). "Galleria medica di David Richfield". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]] La miosina ha un'ampia varietà di funzioni. Myosin I, accanto all'actina, partecipa al movimento dei cheratociti.
La miosina II fornisce rigidità alla membrana plasmatica, partecipa alla citochinesi e alla contrazione muscolare. Entrambi, miosinas I e II, collaborano con la migrazione cellulare. Myosinas I e V eseguono il trasporto di vescicole lungo i filamenti di actin.
[TOC]
Struttura
Nelle micrografie elettroniche, la tipica struttura dell'isoforma della miosina ha tre settori: testa, collo e coda. Attraverso l'idrolisi con chimotripsina, si ottiene un segmento costituito da testa e collo, chiamato meromiosina pesante (HMM) e un segmento di coda, chiamato meromiosina leggera (LMM).
La padronanza della testa è l'estremità N-terminale della catena pesante e il dominio della coda è l'estremità C-terminale della catena leggera.
Le classi di miosina possono essere differenziate per il numero di catene polipeptiche che lo compongono e l'abbondanza e la catena leggera di classe unita.
La miosina I ha una catena polipeptidica, che forma una testa e la sua coda manca di regioni elicide alfa. Mentre miosinas i e v hanno due catene polipeptidiche, e lì.
Myosinas I e V hanno siti sindacali per la calmodulina, che regola e fissa Ca+2, In catene di luce. La miosina ho risolto ca+2 Nelle catene leggere, ma fa così diversamente dalla calmodulina.
Caratteristiche
A livello meccanico, le miosinas hanno tre caratteristiche, vale a dire:
- Il capo della miosina è il dominio motorio che avanza per passi discreti: l'unione della miosina testa a un filamento di actina, la sua inclinazione e la successiva separazione producono il movimento della miosina. Questo processo è ciclico e dipende dall'ATP.
- Cambiamenti di conformazione: l'idrolisi di una molecola ATP è accoppiata ad ogni fase di una molecola di miosina, mediante livelli di amplificazione e trasmissione. Ciò implica grandi cambiamenti conformazionali della miosina.
Può servirti: simmetria radialeIl primo livello di amplificazione è prodotto dalla perdita del gruppo gamma-fosfato dell'ATP, che consente una riorganizzazione degli elementi strutturali nel sito dell'Unione ATP. Questa riorganizzazione è coordinata con cambiamenti strutturali nel sito dell'Unione per actina.
Il secondo livello di amplificazione implica la comunicazione del cambiamento conformazionale nel sito attivo ai componenti strutturali del carbossilica terminale.
- Direzionalità: è stato scoperto che la mia ha una polarità, o direzionalità inversa, verso la fine (+) del filamento di actina. Questa conclusione deriva dagli esperimenti di livellamento del filamento di actina, usando il microscopio ottico a fluorescenza.
Funzioni
La miosina, accanto all'actina, partecipa alla contrazione muscolare, all'adesione cellulare, alla citochinesi, alla garanzia della rigidità alle membrane corticali e allo spostamento di alcune vescicole, tra le altre funzioni.
I difetti della miosina possono produrre condizioni patologiche. Ad esempio, i difetti nelle miosinas I e V sono correlati, rispettivamente, con miopatie di miosina e disturbi della pigmentazione (Sindrome di Griselli). Mentre i disturbi nelle isoforme della miosina VI causano la perdita dell'orecchio.
Contrazione muscolare
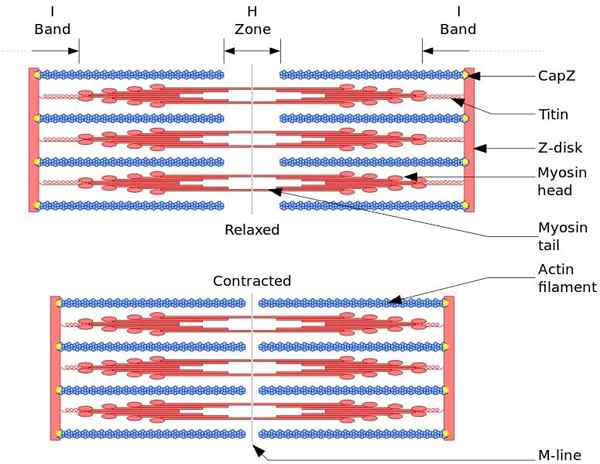
L'unità funzionale e strutturale del muscolo scheletrico è sarcomro. Durante la contrazione muscolare, la lunghezza del sarcamer raggiunge il 30% della sua lunghezza originale.
I sarcomeri sono costituiti da filamenti spessi, miosina e sottili di actina, che sono organizzati in modo complesso. In generale, le teste di miosina si trovano alle estremità distali del filamento e le sue code verso il centro del sarcomero e l'organizzazione è bipolare.
Per fare la contrazione muscolare, le teste di miosina, delle estremità opposte, devono spostarsi sul disco Z o sulla fine (+) del filamento. Poiché l'organizzazione di filamenti spessi è bipolare, si verifica lo scorrimento di filamenti sottili su filamenti spessi, guidato dall'ATP.
La forza di spostamento si verifica perché centinaia di teste di miosina, di uno spesso filamento, interagiscono con un filamento sottile.
Citocinesi
Durante la mitosi, quando i microtubuli dei poli del fuso sono separati, l'actina e la miosina II formano un anello contrattile nella cellula della cellula. Questo anello contrae il suo diametro e dividendo la cella in due parti.
Concessione di rigidità alle membrane corticali
Nelle cellule mutanti prive di miosina II, la membrana plasmatica è facilmente deformata quando viene applicata una forza esterna. Questo accade perché la miosina II fornisce forza di aggregazione alle proteine della membrana plasmatica.
Può servirti: adattamento morfologicoAdesione cellulare
Nel tessuto epiteliale, le travi contrattili di actina e miosina II si trovano nei quartieri della membrana plasmatica e formano una cintura circolare che circonda la superficie cellulare cellulare. Questa cinghia circolare determina la forma della cellula e mantiene l'unione tra le cellule.
Il contatto tra le cellule si verifica da parte dell'unione della cinghia circolare per molecole di adesione cellulare, usando proteine leganti.
Spostamento di alcune vescicole
Le prove sperimentali rivelano che la miosina V esegue il trasporto di membrana dall'apparato Golgi alla periferia della cellula. Alcune prove sono:
- Nelle cellule tissutali nervose, mediante immunofluorescenza degli astrociti si è scoperto che la miosina V si trova accanto a Golgi.
- Nei lieviti, le mutazioni nel gene della miosina V interrompono la secrezione di proteine e, di conseguenza, le proteine si accumulano in citosol.
- Le isoforme della miosina I sono incaricate di trasportare vacuole sulla membrana cellulare. Usando anticorpi specifici contro le isoforme della miosina I, è stato scoperto che queste isoforme si trovano in diverse parti della cellula.
Ad esempio, quando un'ameba vivente è contrassegnata da un anticorpo contro la miosina IC, viene arrestato il trasporto del vacuolo sulla membrana. Per questo motivo, il vacuole si espande e la cellula esplode.
Malattie correlate alla miosina
Miosinas e perdita di orecchio
Esistono numerosi geni e mutazioni che producono la perdita di orecchio. Questa malattia è spesso monogenetica .
Le mutazioni nelle miosinas non convenzionali, con una o due teste di miosina, influenzano il funzionamento dell'orecchio interno. Alcune delle isaformi mutate di miosina sono la miosina IIIA, la miosina VIIA e la miosina XVA. Di recente, due mutazioni sono state scoperte in miosina VI.
Le mutazioni nella miosina VI sono C.897G> T e P.926q. La prima mutazione colpisce una regione che interagisce con la posizione attiva, chiamata switch i. Omozigote per la mutazione presto mostra il fenotipo, causando gravi effetti.
La seconda mutazione influisce su una regione di carico con carico, in un'elica alfa nella coda della miosina VI. Questa regione è importante per la dimerizzazione prossimale del motore e influisce sulla funzione stereo-chart della miosina VI.
Può servirti: scienze ausiliarie della biologiaUn'altra mutazione è P.ASN207Ser, che produce un motore incapace di produrre forza. Questo perché ASN 207 è un residuo di aminoacidi del sito attivo, la cui funzione è l'unione e l'idrolisi dell'ATP.
La mutazione p.Arg657trp produce la perdita della funzione miosina VI. Il residuo arg è coinvolto nei cambiamenti conformazionali che attaccano l'idrolisi al movimento della miosina.
Miosina x e cancro
Myosina X (myo10) è una miosina non convenzionale che è espressa nel cervello, endotelios e molti epitelium. Myo10 e tre tipi di proiezioni a base di actina (filopodi, facoltà e proiezioni simili ai filopodiani) lavorano durante le metastasi del cancro.
Le cellule tumorali invasive hanno un gran numero di filopodi ed esprimono alti livelli di fascia. Questa proteina esegue gli interseca tra i filamenti di actina. Per sfuggire al tumore primario, si formano gli invadie, ricchi di attività proteolitica, che digerisce la matrice extracellulare circostante.
Una volta che le cellule raggiungono la matrice extracellulare, le proiezioni simili ai filopodi aiutano a disperdere e colonizzare. Alti livelli di Myo10 indicano un'elevata aggressività e metastasi nel carcinoma mammario.
Il silenziamento di Myox produce perdita del carattere metastatico delle cellule, che non sono in grado di formare proiezioni a base di actina. Tutte queste proiezioni hanno aderenze basate con integrazione, che vengono trasportate dal MY1010 all'interno del Philopodium.
Myox è coinvolto nella formazione dei centri. L'assenza di myox favorisce la formazione di picchi multipolari. Myox è anche coinvolto nella segnalazione nelle cellule tumorali. Ad esempio, Myox è attivato da 3,4,5, -inositolo trifosfato (PIP3).
Riferimenti
- Alberts, b., Johnson, a., Lewis, J., e cavolo. 2007. Biologia della cellula molecolare. Garland Science, New York.
- Brownstein, Z., Abu-rayyan, a., Karfunkel-Don, d., Sirigu, s., Davido, b., Shohat, m., Frydman, m., Houdusse, a., Kanaan, m., Avraham, k. 2014. Nuove mutazioni di miosina per la perdita dell'udito ereditaria si sono divertite dalla cattura genomica mirata e sequenziamento massicciamente parallelo. European Journal of Human Genetics, 22: 768-775.
- Courson, d.S. e Cheney, R.E. 2015. Miosina-x e malattia. Ricerca cellulare sperimentale, 334: 10-15.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, p., Baltimora, d., Darnell, J. 2003. Biologia cellulare e molecolare. Editoriale Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Messico, Sāo Paulo.
- Schliwa, m. e guaihlke, g. 2003. Motori molecolari. Nature, 422: 759 - 765.
- Per valore.D. 2003. La cassetta degli attrezzi molecolari per il trasporto intacellulare. Cell, 112: 467-480.
- « Caratteristiche, struttura e funzioni di esonucleasi
- Bromo storia, struttura, configurazione elettronica, proprietà, usi »

