Sistema di sodio azida (NAN3), proprietà, usi, rischi

- 2663
- 740
- Benedetta Rinaldi
IL Sodio azide È un solido inorganico cristallino formato dal sodio ione Na+ E l'Azida n ion3-. La sua formula chimica è nan3. Il composto nan3 È il sale di sodio dell'acido idrazoico Hn3. Il nan3 È un solido cristallino di incolore al bianco.
Sebbene sia un composto molto tossico, uno dei suoi lavori più diffusi è stato negli airbag che sono immediatamente infettati durante gli incidenti del veicolo. Serve anche a gonfiare rapidamente le vetrini di emergenza dell'aeromobile. Tuttavia, attualmente il suo uso è molto interrogato in entrambi i casi per la sua tossicità.
 Sodio nan azido3 solido. И.С. Неieme.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Sodio nan azido3 solido. И.С. Неieme.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. È usato nei laboratori di ricerca chimica per sintetizzare vari tipi di composti e in laboratori biochimici per studi con batteri, funghi o mammiferi o cellule umane.
In alcuni laboratori viene utilizzato per sterilizzare materiali o attrezzature, ma alcuni tipi di microrganismi resistono alla loro azione biocida.
È stato anche usato in agricoltura per eliminare i parassiti del suolo o nell'industria del legname per impedire al legno di pino di colorare con funghi.
[TOC]
Struttura
Il sodio azida nan3 È formato da una nazione di sodio+ e un anione azido n3-.
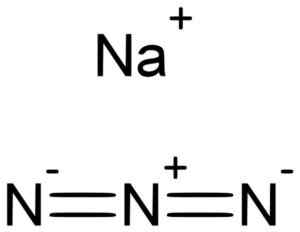 Il sodio azida è formato dal sodio Na+ E l'Azida n ion3-. Lukáš Mižoch [dominio pubblico]. Fonte: Wikimedia Commons.
Il sodio azida è formato dal sodio Na+ E l'Azida n ion3-. Lukáš Mižoch [dominio pubblico]. Fonte: Wikimedia Commons. L'Azida n ion3- È costituito da 3 atomi di azoto (n) uniti l'uno dall'altro da legami covalenti che possono essere semplici, doppi o tripli, poiché gli elettroni sono condivisi tra i tre.
Questo anione ha una struttura lineare, cioè i tre atomi di azoto disposti in linea retta. Inoltre, la struttura è simmetrica.
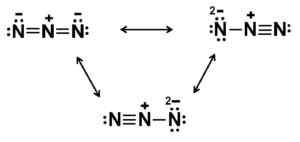 Possibili strutture di Lewis di Azida anion. Autore: Marilú Stea.
Possibili strutture di Lewis di Azida anion. Autore: Marilú Stea. Nomenclatura
- Sodio azide
- Sodio azida
Proprietà
Stato fisico
Cristallino solido incolore al bianco. Cristalli esagonali.
Peso molecolare
65,01 g/mol
Punto di fusione
Si decompone a 275 ºC.
Densità
1.846 g/cm3 a 20 ºC
Solubilità
È molto solubile in acqua: 41,7 g/100 ml a 17 ºC. È leggermente solubile in etanolo e insolubile in etil etere.
Costanti di dissociazione
Ha un PKB 9.3. Soluzioni acquose contengono NH3, che sfugge rapidamente all'ambiente a 37 ºC.
Proprietà chimiche
Il nan3 È molto corrosivo verso l'alluminio e moderatamente verso il rame e il piombo.
Può servirti: valenze di azotoSecondo una certa fonte consultata, il sodio azide non è esplosivo. Si decompone delicatamente e completamente quando viene riscaldato a 300 ºC o più, formando metallo di sodio e gas azoto N2.
2 nan3 → 2 Na + 3 N2↑
È un agente di nitrorazione, ciò significa che serve all'azoto o aggiunge azoto ad altri composti chimici o alla superficie di materiali come l'acciaio.
È stabile in acqua neutra o alcalina in assenza di luce. Si decompone attraverso la radiazione solare.
Proprietà biochimiche
Il sodio azide inibisce un enzima chiamato citocromo ossidasi che si trova nei mitocondri delle cellule ed è significativamente coinvolto nella respirazione e nella generazione di energia in questo.
La sua azione impedisce la generazione di ATP da un composto chiave nelle attività cellulari e la cellula si deteriora o danneggia.
Se viene ingerito, inalato o contatto con l'azide di sodio, è molto tossico e può diventare letale.
Ottenimento
Nh ammoniaca sta reagendo3 Con sodio metallo Na a 350 ºC in un contenitore in acciaio chiuso, ottenendo l'ammide da sodio nanh2.
Sodio nanh2 Sta reagendo con il monossido di dyitrogen n2O a 230 ° C in un reattore in nichel, e quindi si forma una miscela di sodio nan3, Sodio idrossido NaOH e ammoniaca NH3.
2 Nanh2 + N2O → nan3 + NaOH + NH3
Può anche essere ottenuto reagendo l'ammide di sodio con nitrato di nano sodio3 a 175 ºC:
3 Nanh2 + Fratello maggiore3 → Nan3 + 3 NaOH + NH3
Per purificare l'azido, l'acqua viene aggiunta alla miscela, i cristalli dell'azide vengono lavati e quindi l'acqua evapora. Il materiale cristallino che rimane è l'azide di sodio nan3 che poi si asciuga a 110 ºC.
Applicazioni
In veicoli a motore e aeromobili
Il sodio azide è stato ampiamente utilizzato nell'industria automobilistica come generatore di azoto per gonfiare rapidamente gli airbag (inglese Airbags) Sicurezza dei volantini e dei camion quando si verifica un impatto.
È stato anche usato in vetrini gonfiabili che servono a fuggire rapidamente dall'interno degli aerei che sono atterrati in situazioni di emergenza.
In entrambi i casi, il meccanismo comporta l'azione di una scintilla per produrre la reazione immediata tra sodio azide e alcuni composti, generando gas azoto n2 e ossido di sodio Na2O.
Può servirti: reazione a doppia sostituzioneQuesta applicazione richiede il rilascio immediato di un gas freddo e non tecnico, quindi l'azoto è il gas più appropriato.
 Borse di sicurezza che sono già state utilizzate nei veicoli. Autore: Marcel Langthim. Fonte: Pixabay.
Borse di sicurezza che sono già state utilizzate nei veicoli. Autore: Marcel Langthim. Fonte: Pixabay. Tuttavia, questo uso sta diminuendo a causa della tossicità dell'azide di sodio e invece sono usati meno composti tossici.
Nell'industria chimica
Viene usato come ritardante nella produzione di gomma per le spugne, per prevenire la coagulazione del lattice elastico o butadiene quando sono conservati a contatto con metalli e per decomporre i nitriti in presenza di nitrati.
In agricoltura
È stato usato in agricoltura: come biocida e fumigante, è anche nematico, cioè è applicato nei suoli per eliminare i nematodi, che sono parassiti che attaccano alcune colture.
 Danno causato dai nematodi alla radice di una pianta. Autore: Redwolf. [http: // www.Ars-Grin.Gov/Ars/Soatlantic/FP/STPP/Burelle/Burelle.HTML] Fonte: Wikimedia Commons.
Danno causato dai nematodi alla radice di una pianta. Autore: Redwolf. [http: // www.Ars-Grin.Gov/Ars/Soatlantic/FP/STPP/Burelle/Burelle.HTML] Fonte: Wikimedia Commons. Ha anche funzionato come erbicida ed evitare frutti in decomposizione.
Recentemente NAN3 È stato usato nella preparazione di semi di gombo o quimbombó per osservare la sua resistenza alle condizioni dell'acqua in acqua.
I semi a cui Nan era stato precedentemente applicato3 Hanno generato piantine che hanno ritirato meglio le condizioni di inondazione rispetto a quelle irragionevoli, hanno migliorato l'altezza delle piante, hanno aumentato il numero di foglie e hanno aumentato la quantità di radici anche con l'eccesso di acqua.
Nella preparazione di altri composti chimici
È usato come reagente chimico nella sintesi di composti organici, ad esempio per preparare molte azidi organici, come le azidi del gruppo alchilico terziario, che sono importanti nella sintesi chimica.
Serve a preparare l'acido idrazoico (HN3) e sodio puro (Na).
Nel settore esplosivo
Il sodio azida nan3 È un intermediario nella produzione esplosiva, in quanto viene utilizzato per la preparazione di azide di piombo3)2. Quest'ultimo è un composto che esplode quando è stato battuto fortemente, quindi viene utilizzato nella costruzione di dispositivi di detonazione.
 Il sodio azida nan3 Viene utilizzato per produrre il piombo PB (n3)2 composto che fa parte dei dispositivi per generare esplosioni. Autore: vettori di OpenClipart. Fonte: Pixabay.
Il sodio azida nan3 Viene utilizzato per produrre il piombo PB (n3)2 composto che fa parte dei dispositivi per generare esplosioni. Autore: vettori di OpenClipart. Fonte: Pixabay. Nei laboratori biochimici
Il sodio azide viene utilizzato quando sono necessarie attrezzature da laboratorio sterile, in quanto è in grado di distruggere diversi tipi di microrganismi.
Può servirti: acido pituitario (H3PO2): proprietà, usi e reagentiÈ un agente biocida. Tuttavia, alcune fonti indicano che alcuni tipi di batteri sono resistenti alla loro azione.
Ciò si ottiene bloccando il sito di legame dell'ossigeno nel citocromo ossidasi che è un enzima coinvolto nel processo di produzione di energia di alcuni microrganismi.
È utilizzato nei contatori ematici automatici, anche nella selezione differenziale dei batteri e per preservare le soluzioni di reagenti di laboratorio perché impedisce la crescita di alcuni microrganismi in questi.
In diversi usi
Il sodio azida serve nell'industria del legno per evitare la crescita di macchie di funghi marroni sul legno di pino.
È stato anche utilizzato nell'industria della birra giapponese per evitare lo sviluppo di un fungo che oscura quella bevanda.
Rischi
Il sodio azide è un composto tossico che inibisce un importante enzima per la respirazione e la vita delle cellule umane e animali. È stato scoperto che può influenzare seriamente le cellule del tessuto cellulare del vaso sanguigno cerebrale.
Il suo effetto immediato dopo l'ingestione, l'inalazione o il contatto con la pelle è ridurre pericolosamente la pressione sanguigna, il che può portare alla morte. Pertanto, deve essere manipolato con grande cautela.
Ci sono fonti di informazioni che attirano l'attenzione sugli airbag dei veicoli che vengono distrutti per i terreni di scarto.
In tali casi, le persone che non conoscono il pericolo potrebbero accedere ai depositi NAN3, Questo è un composto molto tossico. Inoltre, esiste un pericolo di contaminazione con NAN3 suolo e acque.
Allo stesso modo, durante gli incidenti, le collisioni o gli incendi del veicolo potrebbero essere esposti a NAN3 E questo può essere sottovalutato o sconosciuto dal personale medico che frequenta l'emergenza.
Attenzione alla mostra di personale di laboratorio che lo usa è stato anche chiamato.
Riferimenti
- Vwioko, e.D. et al. (2019). L'innesco del sodio azide migliora la tolleranza allo stress da logging nell'aoiatura (Abelmoschus esculentus). Agronomy 2019, 9, 670. MDPI si è ripreso.com.
- Kho, d.T. et al. (2017). Morte del sangue barriera cerebrale cellule endoteliali in azide di sodio e i suoi prodotti gassosi. Biosensori 2017, 7, 41. MDPI si è ripreso.com.
- O.S. Biblioteca nazionale di medicina. (2019). Sodio azide. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov.
- Talavera, m. et al. (2019). Gestione dei nematodi nei campi di fragola della Spagna meridionale. Agronomy 2019, 9, 252. MDPI si è ripreso.com.
- Okano, t. et al. (1995). Meccanismo di distacco cellulare da superfici polimeriche idrofili-idrofobiche modulate a temperatura. In The Biomaterials: Silver Jubilee Compendium. Recuperato da ScienceDirect.com.
- L'enciclopedia di chimica industriale di Ullmann. (1990). Quinta edizione. Volume A22. VCH Verlagsgellschaft MBH.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Chang, s. e lamm, s.H. (2003). Effetti sulla salute umana dell'esposizione azide di sodio: una revisione e analisi della letteratura. Int J Toxicol 2003, 22 (3): 175-86. NCBI recuperato.Nlm.NIH.Gov.

