Caratteristiche di supporto, funzioni ed esempi
- 4578
- 1301
- Baldassarre Ross
IL Supporti Sono le forme inattive di enzimi, cioè sono gli enzimi che mancano dei loro cofattori o coenzimi, che sono essenziali per eseguire le reazioni catalitiche di cui sono responsabili.
Gli enzimi sono proteine con attività catalitica. La sua funzione sta fondamentalmente accelerando il corso di diversi tipi di reazioni chimiche nelle cellule, un fatto che è molto importante per l'esistenza di tutti gli esseri viventi sulla Terra.
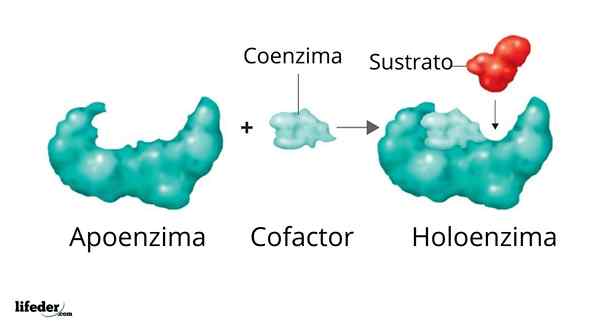
 Un oloenzima è formato da un sostenitore e dal suo gruppo di cofattore/coenzima/protesi
Un oloenzima è formato da un sostenitore e dal suo gruppo di cofattore/coenzima/protesi L'attività di molti enzimi dipende dall'identità e dall'ordinamento degli aminoacidi che li comprendono, cioè dalle loro strutture proteiche e dall'integrità di queste strutture in condizioni nativo.
Mentre questo è vero per molti enzimi, ci sono alcuni che richiedono ulteriori elementi non proteici per svolgere le loro funzioni. Tali elementi sono noti come Cofattori, Se questi sono ioni inorganici, o coenzimi, Se queste sono molecole complesse o organiche.
In generale, sia i cofattori che i coenzimi sono associati alla stabilità relativa alla struttura proteica degli enzimi la cui attività catalitica promuove; Quando questa associazione è permanente (covalente), questi gruppi sono quindi noti come Gruppi protesici.
Esempi di supporto
 Illustrazione 3D di DNA polimerasi
Illustrazione 3D di DNA polimerasi Il set enzimatico attivo formato da una proteina con attività catalitica e il suo gruppo di cofattore/coenzima/protesi è chiamato Oloenzima O enzima coniugato. In un oloenzima, la porzione proteica corrisponde a ciò che è noto come supporto o apoproteina, che manca di attività.
Esempi di alcuni supporti importanti sono:
- L'enzima DNA polimerasi, Responsabile della replica del DNA cellulare, senza lo ione di magnesio bivalente che funge da cofattore.
- L'enzima Anidrasi carbonica, responsabile di catalizzare la conversione di CO₂ e H₂0 in bicarbonato e ioni H+, senza lo ione di zinco bivalente che funge da cofattore.
- L'enzima emoglobina, responsabile del trasporto di ossigeno all'interno dei globuli rossi (eritrociti) dal sangue degli animali mammiferi, senza il loro gruppo protesico Hemo.
- L'enzima lattato deidrogenasi, responsabile della produzione di lattato dal piruvato, senza il NADH che funge da cofattore.
Caratteristiche degli apoenzimi
Il supporto sono enzimi inattivi di cui hanno bisogno, per raggiungere la loro attivazione, l'unione di un cofattore o un coenzima, ma che non sono uniti a uno.
Tenendo conto di questo, si può dire che tali molecole condividono alcune caratteristiche, vale a dire:
Sono proteine
A differenza dei cofattori e dei coenzimi, che sono elementi non proteici necessari per le funzioni degli oloenzimi, il supporto sono le proteine.
L'affermazione precedente è compresa, quindi, che i supporti sono formati da catene di molecole speciali note come aminoacidi, che sono collegate tra loro attraverso un tipo di link noto come legame peptidico.
La sequenza di aminoacidi di ciascun supporto è geneticamente determinata e questo, a sua volta, condizioni il suo ordine spaziale o tre -dimensionale, intimamente correlato alla specificità dei substrati, l'unione ai cofattori/coenzimi/gruppi prospesti eccetera.
Come proteine, anche gli apoenzimi hanno: una carica elettrica, determinata dal loro contenuto di aminoacidi e dal pH del mezzo in cui si trovano; Requisiti di temperatura, pH e forza ionica caratteristica in cui può, in presenza di cofattori, funzionare alla loro velocità ottimale; inibitori e concorrenti, ecc.
Possono unirsi ai substrati
Sebbene non siano in grado, da soli, di catalizzare una reazione enzimatica, molti supporti mantengono la capacità di unirsi ai substrati che partecipano alla reazione che li caratterizza; Per questo motivo vengono solitamente usati in alcuni contesti sperimentali.
Possono unirsi a cofattori, coenzimi o gruppi protesici
Nella maggior parte dei casi, i supporti possono essere considerati enzimi inattivi che sono preparato Unirsi a quelle molecole che partecipano alle loro funzioni, cioè ai loro cofattori, coenzimi o gruppi protesici.
Può servirti: flora e fauna della costa ecuadorianaI cofattori possono partecipare direttamente alle reazioni catalitiche o semplicemente contribuire alla stabilizzazione della struttura generale dell'oloenzima.
Tra i principali cofattori che partecipano agli oloenzimi cellulari ci sono:
- Iron (Fe2+)
- Rame (Cu2+)
- Calcio (Ca2+)
- Zinco (zn2+)
- Magnesio (MG2)
- Manganese (Mn2+)
- Cobalt (CO)
- Nichel (NI)
Tra i coenzimi principali possono essere nominati:
- Vitamine: B9, B3, C
- Adenosín Triffosfato (ATP)
- Flavín Adenín Dinucleotide (FAD)
- Nicotinamide o nicotín dinucleotide dycleotide (NAD)
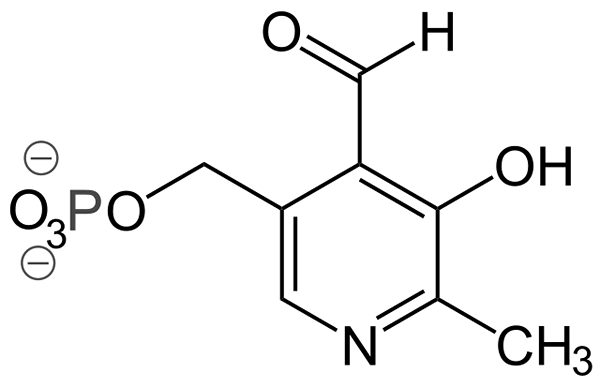 Struttura piridoxal-fosfato (fonte: ayacop, dominio pubblico, via Wikimedia Commons)
Struttura piridoxal-fosfato (fonte: ayacop, dominio pubblico, via Wikimedia Commons) Alcuni importanti gruppi protesici sono:
- Gruppo di Hemo
- Biotina
- Tiamina pirofosfato
- Piridoxal-fosfato
Funzioni dei subenzima
Poiché i supporti sono le porzioni proteiche degli oloenzimi, è giusto considerarli come la loro parte più importante. Anche in presenza dei coenzimi, coenzimi e substrati appropriati, senza i supporti, nessuna delle reazioni enzimatiche catalizzate da questi enzimi potrebbe essere effettuata.
In questo senso, la funzione principale di un supporto è quella di contribuire sia la struttura principale dell'oloenzima a cui appartiene, come sito dell'Unione per il cofattore, il coenzima e/o il gruppo protesico e i substrati che partecipano alla reazione.
Dal punto di vista strutturale, un oloenzima senza il suo apoenzima non è altro che un cofattore, e solo un cofattore non è altro che una molecola relativamente inerte (biologicamente parlando), in modo che il supporto sia responsabile, nella realtà, da svolgere La reazione catalitica, assistita dagli elementi non proteici menzionati.
Può servirti: actinomicetesPertanto, le funzioni del supporto, sebbene siano enzimi inattivi, dipendono da:
- La sua catena lineare di aminoacidi o struttura primaria (se sono complessi enzimatici formati da più di una subunità, allora sarebbe discusso delle "loro catene lineari").
- Il modo in cui queste catene sono ordinate nello spazio, cioè strutture secondarie, terziarie e quaternarie, quando il caso.
- La corretta conformazione dei siti fondamentali per la catalisi, cioè il sito catalitico con gli aminoacidi che partecipano alla reazione, al sito dell'Unione per i co -enzimi, coenzimi o gruppi protesici; eccetera.
- La stabilità della struttura in condizioni cellulari o nativo, fatto che è direttamente correlato alla capacità dell'apoenzima di formare oloenzima e altri.
Riferimenti
- Boyer, p. D., & Krebs, e. G. (1986). Gli enzimi. Academic Press.
- Garrett, r. H., & Grisham, C. M. (2001). Principi di biochimica: con un focus umano. Brooks/Cole Publishing Company.
- Gruber, k., Puffer, b., & Kräutler, B. (2011). Vifattori e ligandi e ligandi e ligandi di proteine e acidi nucleici-enzimi di vitamina B. Recensioni della Chemical Society, 40 (8), 4346-4363.
- Murray, r. K., Granner, d. K., Mayes, p. A., & Rodwell, V. W. (2014). Biochimica illustrata di Harper. McGraw-Hill.
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.
- Staiano, m., Pennacchio, a., Varriale, a., Capo, a., Majoli, a., Capacchione, c., & D'Auria, s. (2017). Enzimi come sensori. In Metodi in enzimologia (vol. 589, pp. 115-131). Academic Press.
- « Petitore per quello che è l'uso, esempio, formato (modello)
- Respirazione ramificata come è fatto e esempi »

