Storia, struttura, proprietà, usi e rischi di antimonio

- 3538
- 522
- Kayla Serr
Lui antimonio È una libent -metalloide d'argento e con una certa tonalità blu. Il suo solido è anche caratterizzato dall'essere molto fragile e di consistenza squamosa. Appartiene al gruppo 15 della tavola periodica, guidata da azoto. Dopo il bismuto (e il Mosca), è l'elemento più pesante del gruppo.
È rappresentato dal simbolo chimico SB. In natura si trova principalmente nei minerali di Stabit e Ullmannite, le cui formule chimiche sono SB2S3 e NISBS, rispettivamente. La sua alta tendenza a formare solfuri anziché ossidi è perché è chimicamente morbido.
 Antimonio cristallino. Fonte: Best Sci-Fatcs [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Antimonio cristallino. Fonte: Best Sci-Fatcs [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] D'altra parte, l'antimonio è anche fisicamente morbida, presenta una durezza di 3 sulla scala MOHS. È stabile a temperatura ambiente e non reagisce con l'ossigeno dell'aria. Ma quando riscaldato in presenza di ossigeno, forma il triossido di antimonio, SB2O3.
È anche resistente all'azione degli acidi deboli; Ma il caldo viene attaccato da acidi nitrici e cloridi.
L'antimonio ha numerose applicazioni, tra cui viene utilizzata in leghe con piombo e stagno, nella produzione di batterie per veicoli, materiali a basso attrito, ecc.
Questa metalloide ha il raro di proprietà di aumentare il volume quando si è consolidata, consentendo alle sue leghe di occupare completamente lo spazio usato per modellare lo strumento che si desidera produrre.
[TOC]
Storia della tua scoperta
AVANTI CRISTO
Ci sono prove che da 3100 a.C, il solfuro di antimonio è stato usato come cosmetico in Egitto. In Mesopotamia, attuali Iraq, resti di un vaso e un altro artefatto sono stati trovati che presumibilmente risalgono tra 3000 e 2200 anni a.C, in cui è stato usato nella sua elaborazione antimonio.
Introduzione del termine
Roman Erúdito Plinio El Viejo (23-79 d.c) ha descritto l'uso di antimonio, che ha chiamato Estibio, nell'elaborazione di sette medicine nel suo trattato di storia naturale. Alchimista Abu Mussa Jahir Ibn Hayyan (721-815) è attribuito all'introduzione del termine antimonio per nominare l'elemento.
Ha usato la seguente etimologia: "Anti" come sinonimo di negazione e "mono" solo per. Quindi voleva sottolineare che l'antimonio non era solo in natura. È già noto che fa parte dei minerali dello zolfo, che come altri elementi.
Ottenimento
Si ritiene che il naturista greco pedanius diascorides ottenga antimonio puro, riscaldando il solfuro di antimonio in un flusso d'aria. Il vannocio biringucio metallurgico italiano, nel libro della pirotecnica (1540), fa una descrizione di un metodo per isolare l'antimonio.
Il chimico tedesco Andreas Libavius (1615), attraverso l'uso di una miscela fusione di ferro, solfuro di antimonio, sale e potassio tartrato, ottenne la produzione di un'antimonio cristallino.
Il primo rapporto dettagliato sull'antimonio fu fatto nel 1707 dal chimico francese Nicolas Lemery (1645-1715), nel suo libro curato sull'antimonio.
Può servirti: cloruro di rame (i) (cucl): struttura, proprietà, usiStruttura antimonio
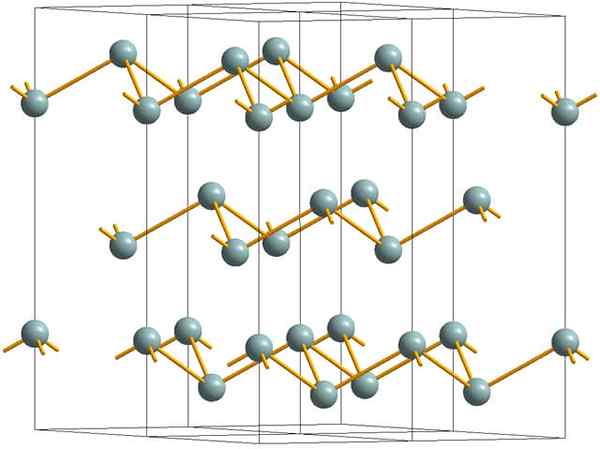 Strati rugosi che costituiscono la struttura cristallina dell'antimonio metallico o d'argento. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Strati rugosi che costituiscono la struttura cristallina dell'antimonio metallico o d'argento. Fonte: MaterialScientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] L'immagine superiore mostra la struttura degli strati rugosi adottati dagli atomi di arsenico. Tuttavia, anche l'antono grigiastro, meglio conosciuta come antimonio metallico, adotta questa struttura. Si dice che sia "rugoso" perché ci sono atomi SB che si alzano e cadono dal piano composto dallo strato.
Questi strati, sebbene siano responsabili dei fotoni che interagiscono con esso per brillare di luccichi d'argento, rendendo l'antimonio come un metallo, la verità è che le forze che li uniscono sono deboli; Da qui ai frammenti di metallo apparenti di SB possono essere facilmente mostrati e sono fragili o sneaker.
Inoltre, gli atomi SB negli strati rugosi non sono sufficienti per raggruppare i loro orbitali atomici e quindi creare una banda che consenta una conduzione elettrica.
Vedendo una sfera grigiastra singolarmente, puoi vedere che ha tre collegamenti SB-SB. Da un piano più alto, l'SB poteva essere visto al centro di un triangolo, con tre SB situati ai suoi vertici. Tuttavia, il triangolo non è piatto e ha due livelli o piani.
La riproduzione laterale di tali triangoli e i loro collegamenti stabilisce strati rugosi, che sono allineati per formare cristalli romboébici.
Alotropia
La struttura appena descritta corrisponde all'antimonio grigiastro, il più stabile dei suoi quattro alotropi. Gli altri tre alotropi (neri, gialli ed esplosivi) sono metastabili; cioè, possono esistere in condizioni molto rigorose.
Non ci sono troppe informazioni sulle sue strutture. È noto, tuttavia, che l'antimonio nero è amorfo, in modo che la sua struttura sia disordinata e complessa.
L'antimonio giallo è stabile al di sotto di -90ºC, si comporta come un elemento non metallico e può essere congetturata che consiste in piccoli agglomerati SB4 (simile al fosforo); Quando riscaldato si trasforma in Alotrope nero.
E rispetto all'antimonio esplosivo, è costituito da un serbatoio gelatinoso formato sul catodo durante l'elettrolisi di una soluzione acquosa di un alogenuro di antimonio.
Al minimo Rubb forte.
Proprietà
Peso atomico
121,76 g/mol.
Numero atomico
51.
Configurazione elettronica
[Kr] 4D105s25 p3.
Stati di ossidazione
-3, -2, -1, +1, +2, +3, +4, +5.
Descrizione fisica
Sargento lucido, fragile, squamoso superficie, con una tonalità blu. Può anche apparire come una polvere nera.
Punto di fusione
630,63 ºC.
Punto di ebollizione
1.635 ºC.
Densità
-6.697 g/cm3 a temperatura ambiente.
-6,53 g/cm3 In stato liquido, temperatura pari o superiore al punto di fusione.
Calore di fusione
19,79 kJ/mol.
Calore di vaporizzazione
193.43 kj/mol.
Può servirti: solfuro di rame: struttura, proprietà, usiCapacità calorica molare
25,23 J/mol.K
Elettronegatività
2.05 (Pauling Scale).
Radio atomica
140 pm.
Durezza
È un elemento morbido, con una durezza di 3 sulla scala MOHS e può essere graffiato da vetro.
Stabilità
È stabile a temperatura ambiente, non sperimenta l'ossidazione. È anche resistente all'attacco acido.
Isotopi
Ha due isotopi stabili: 121SB e 123Sb. Inoltre, ci sono 35 isotopi radioattivi. L'isotopo radioattivo 125SB è quello con la più grande e mezza vita: 2,75 anni. In generale, gli isotopi radioattivi emettono radiazione β+ e β-.
Conducibilità elettrica e termica
L'antimonio è un cattivo conduttore di calore ed elettricità.
Reattività chimica
Non può spostare l'idrogeno dagli acidi diluiti. Forma complessa ionica con acidi organici e inorganici. L'antimonio metallico non reagisce con l'aria, ma viene rapidamente convertita in ossido nell'aria bagnata.
Alogeni e solfuri ossidano facilmente l'antimonio, se il processo si verifica ad alte temperature.
Applicazioni
Leghe
L'antimonio viene utilizzata in lega con piombo per l'elaborazione di piastre per le batterie per auto, migliorando la resistenza delle piastre, nonché le caratteristiche dei carichi.
La lega di piombo e stagno è stata utilizzata per migliorare le caratteristiche delle saldature, nonché quella dei proiettili e delle cartucce di Tracer. Viene anche utilizzato in leghe per il rivestimento per cavi elettrici.
L'antimonio è utilizzata nelle leghe antifrizione, nella preparazione di bucce e leghe indurite con basso contenuto di stagno nella produzione di organi e altri strumenti musicali.
Presenta la caratteristica, condivisa con l'acqua, di un volume crescente quando è condensato; Quindi l'antimonio presente in leghe con piombo e stagno, riempie tutti gli spazi degli stampi, migliorando la definizione delle strutture fatte con queste leghe.
Ignifugo
Il triossido di antimonio viene utilizzato per l'elaborazione dei composti accusati, sempre in combinazione con ritardanti di fuoco alogenati, bromuros e cloruro.
I ritardatari del fuoco possono reagire con ossigeno e atomi radicali OH, che inibiscono il fuoco. Questi accendi sono usati nei vestiti per bambini, giocattoli, aerei e seggiolini per auto.
Vengono anche aggiunti nelle resine di poliestere e nei compositi in fibra di vetro per oggetti usati come i motori aeronautici leggeri coprono.
I composti di antimonio che vengono usati come ritardanti di incendi includono: ossicloruro di antimonio, sbocl; Pentossido di antimonio, SBO5; Antimonio tricloruro, SBCL3; e triossido di antimonio, SBO3.
Campo elettronico
Viene utilizzato nella produzione di semiconduttori, diodi, rilevatori a infrarossi medi e nell'elaborazione dei transitori. L'antimonio ad alta purezza, utilizzata nella tecnologia dei semiconduttori, è ottenuta dalla riduzione dei composti antimonio con idrogeno.
Può servirti: fattori che influenzano la solubilitàMedicina e veterinaria
I composti di antimonio sono stati usati in medicina fin da tempi antichi come Eméticas e Antiprotozoa. Il potassio potassio tartrato (tartaro estetico) è stato usato come antisquisosomiale per lungo tempo; Utilizzato anche come espettorante, diaforetico ed emético.
I sali di antimonio sono stati anche usati nel condizionamento della pelle degli animali ruminanti; come aniomalina, litio e antimonio tiomalato.
L'antimonio di meglumina è un farmaco usato nel trattamento della leishmaniosi nei riflettori esterni degli animali domestici. Sebbene, i benefici terapeutici erano scarsi.
Pigmenti e dipinti
I composti di antimonio sono usati nell'elaborazione di vernici e opacificatore negli smalti. Sono anche usati nei pigmenti di Bermellón, giallo e arancione, che sono prodotti di lenta ossidazione di solfuri di antimonio.
Alcuni dei suoi sali organici (tartratos) sono utilizzati nell'industria tessile per aiutare nel collegamento di alcuni coloranti.
Il solfuro di antimonio è stato usato nell'antico Egitto come cosmetico nell'oscuramento degli occhi.
Altri usi
Alcuni sali di antimonio sono usati come agenti di rivestimento per eliminare le bolle microscopiche che si formano sugli schermi televisivi. Gli ioni antimonio interagiscono con l'ossigeno, eliminando la loro tendenza a formare bolle.
Il solfuro di antimonio (III) viene utilizzato nelle teste di alcune partite di sicurezza. Il solfuro di antimonio è anche usato nella stabilizzazione del coefficiente di attrito dei materiali utilizzati nelle pastiglie dei freni per auto.
L'isotopo 124SB, insieme al berillio, viene utilizzato come fonte di neutroni, con una media energetica di 24 kev. Inoltre, l'antimonio viene utilizzato come catalizzatore nella produzione di materie plastiche.
Rischi
È un elemento fragile, quindi durante la manipolazione può verificarsi una polvere inquinante dell'ambiente. Nei lavoratori esposti a polvere di antimonio, dermatite, renite, infiammazione di elevato tratto respiratorio e congiuntivite è stata osservata.
La pneumoconiosi è stata descritta, a volte combinata con cambiamenti polmonari ostruttivi, dopo esibizioni prolungate.
La triossido di antimonio può causare danni al funzionamento cardiaco che può essere mortale.
Nelle persone esposte a questo elemento, è stata osservata la presenza di infezioni pustolose della pelle, di natura transitoria.
L'assunzione continua a bassa dose di questo metallo può causare vomito di diarrea e ulcere allo stomaco. Inoltre, la massima concentrazione tollerabile nell'aria è 0,5 mg/m3.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Manny. (11 marzo 2009). Antimonio giallo e antimonio esplosivo. Estratto da: AntimonyProperties.Blogspot.com
- Prof. Ernst Cohen e J. C. Van den Bosch. (1914). L'allotropia dell'antimonio. Procedimenti Royal Acad. Amsterdam. Vol. XVII.
- Wikipedia. (2019). Antimonio. Recuperato da: in.Wikipedia.org
- Advameg, inc. (2019). Antimonio. Recuperato da: chimica esplicata.com
- Mc'oneal Sabre. (15 settembre 2018). Chimica: proprietà e applicazione dell'antimonio SB. Recuperato da: medio.com
- « Storia della biogeografia, quali studi e esempi di ricerca
- Cause di inquinamento uditivo, conseguenze, soluzioni »

