Ammine

- 2544
- 646
- Benedetta Rinaldi
Quali sono le ammine?
IL ammine Sono composti organici derivati dall'ammoniaca. In essi ci sono sindacati covalenti tra carbonio e azoto. Naturalmente, la molecola di azoto è cineticamente inerte; Ma grazie alla fissazione biologica, diventa ammoniaca, che a sua volta subisce successive reazioni di alchilazione.
Quando l'ammoniaca viene "affittata", sostituisce uno, due o tre dei suoi tre idrogeni con atomi di carbonio. Questi carboni possono anche provenire da un gruppo di noleggio (R) o aril (AR). Pertanto, ci sono ammine alifatiche (lineari o ramificate) e aromatiche.
Le ammine sono basi organiche più forti della stessa ammoniaca. Sono facilmente rimovibili dalla materia vegetale e generalmente hanno forti interazioni con la matrice neuronale di organismi; Quindi, molti farmaci e farmaci sono costituiti da ammine con strutture e sostituenti complessi.
Struttura amminica
 Formula generale per un'ammina. Fonte: Mache, Wikimedia Commons.
Formula generale per un'ammina. Fonte: Mache, Wikimedia Commons. Sebbene varia a seconda della natura di R, l'ambiente elettronico dell'atomo di azoto è lo stesso per tutti loro: tetraedrico. Ma, avendo un paio di elettroni non condivisi sull'atomo di azoto (··), la geometria molecolare diventa piramidale. Questo è così con ammoniaca e ammine.
Le amine possono essere rappresentate con un tetraedro, nonché come è fatto con composti di carbonio. Quindi, nh3 e ch4 Sono disegnati come tetraedri, dove la coppia (··) si trova in uno dei vertici sopra l'azoto.
Entrambe le molecole sono acquatiche; Tuttavia, iniziano a presentare la chiralità mentre la loro h sostituisce. L'Amina r2NH è acquarale se i due R sono diversi. Tuttavia, manca di qualsiasi configurazione per differenziare un enantiomer da un altro (come accade con i centri di carbonio chirale).
Questo perché gli enantiomeri:
R2N-h | H-nr2
Sono scambiati a una velocità in modo tale che nessuno dei due può isolare; e quindi, le strutture delle ammine sono considerate acquarali anche quando tutti i sostituenti nell'atomo di azoto sono diversi.
Proprietà amine
Polarità
Le ammine sono composti polari, dal gruppo amino NH2, Per avere un atomo di azoto electonegativo, contribuisce al momento dipolo della molecola. Si noti che l'azoto ha la capacità di donare legami idrogeno, che generalmente hanno elevati punti di ebollizione e fusione.
Caratteristiche fisiche
Nel mondo della chimica, quando si parla di un'ammina, sorge l'atto involontario di coprirsi il naso. Questo perché, in generale, di solito hanno odori spiacevoli, alcuni dei quali appaiono a quello dei pesci marci.
Può servirti: reazione di MaillardInoltre, le ammine liquide di solito hanno tonalità giallastre, che aumentano la sfiducia che generano.
Solubilità dell'acqua
Le ammine tendono ad essere insolubili nell'acqua perché, nonostante sia in grado di formare ponti idrogeno con l'H₂O, la sua componente organica a maggioranza è idrofobica. Più ingombranti o lunghi i gruppi R, meno la loro solubilità in acqua sarà.
Quando c'è un acido nel mezzo, tuttavia, la solubilità viene aumentata dalla formazione di quelli che sono noti come sali di ammina. In essi, l'azoto ha un carico parziale positivo, che attira elettrostáticamente alla base coniugata anionica o acido.
Basicità
Le ammine sono basi organiche più forti dell'ammoniaca. Maggiore è la densità elettronica attorno all'atomo di azoto, più sarà semplice; cioè, gli acidi del mezzo non proteggeranno più rapidamente. Se l'ammina è molto semplice, può persino strappare il protone dagli alcoli.
Tipi (primario, secondario, terziario)
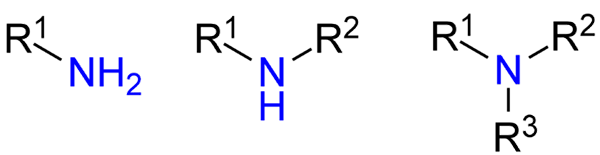 Tipi di ammine. Fonte: Jü via Wikipedia.
Tipi di ammine. Fonte: Jü via Wikipedia. Sebbene non siano stati presentati formalmente, è stato fatto riferimento alle ammine primarie, secondarie e terziarie (immagine superiore, da sinistra a destra).
Ammine primarie (RNH2) sono monosustuidas; Il secondario (r2NH), sono sciolti, con due gruppi R alcomili o arilici; e il terziario (r3N), sono trisustuidi e manca di idrogeno.
Tutte le ammine esistenti derivano da questi tre tipi, quindi la loro diversità e le loro interazioni con la matrice biologica e neuronale sono enormi.
In generale, ci si potrebbe aspettare che le ammine terziarie siano le più basilari; Tuttavia, tale affermazione non può essere fatta senza conoscere le strutture di R.
Formazione di ammine
Alchilazione dell'ammoniaca
Inizialmente è stato menzionato che le ammine derivano dall'ammoniaca; Pertanto, il modo più semplice per formarli è attraverso la loro alchilazione. Per fare ciò, un eccesso di ammoniaca viene reagito con un alogenuro alchilico, seguito dall'aggiunta di una base per neutralizzare il sale amminico:
NH3 + Rx => rnh3+X- => Rnh2
Si noti che questi passaggi portano a un'amina primaria. Si possono anche formare le ammine secondarie e persino terziarie, quindi le prestazioni per un singolo prodotto diminuiscono.
Alcuni metodi di allenamento, come la sintesi di Gabriel, consentono di ottenere ammine primarie in modo che altri prodotti indesiderati non siano formati.
Può servirti: alcol etilico: struttura, proprietà, usi, ottenimentoAllo stesso modo, chetoni e aldeidi possono essere ridotti in presenza di ammoniaca e ammine primarie, per dare origine a ammine secondarie e terziarie.
Idrogenazione catalitica
I composti nitro possono essere ridotti in presenza di idrogeno e un catalizzatore per trasformarsi nelle loro corrispondenti ammine.
Arno2 => Rnah2
The Nitrilos, RC≡n e The Amidas, RConr2, Sono inoltre ridotti per dare rispettivamente ammine primarie e terziarie.
Nomenclatura
Come vengono nominate le ammine? Il più delle volte sono nominati secondo R, il gruppo Aquilo o Arilico. Al nome di R, derivato dal suo alcano, la parola "amine" gli viene aggiunta alla fine.
Quindi, ch3Cap2Cap2NH2 È propilamina. D'altra parte, può essere nominato solo l'alcano e non come un gruppo R: propanamina.
Il primo modo per nominarli è tanto conosciuto e usato.
Quando ci sono due gruppi NH2, L'alkane è nominato e le posizioni dei gruppi amminici sono elencate. Quindi, h2NCH2Cap2Cap2Cap2NH2 Si chiama: 1.4-butanodiamina.
Se ci sono gruppi ossigenati, come OH, la priorità dovrebbe essere data a NH2, che viene nominato sostituente. Ad esempio, Hoch2Cap2Cap2NH2 è chiamato: 3-aminopropanolo.
E rispetto alle ammine secondarie e terziarie, vengono fatte le lettere per indicare i gruppi R. La catena più lunga manterrà il nome del composto. Quindi, Cho3NHCH2Cap3 Si chiama: n-metiletilammina.
Usi delle ammine
Coloranti
Le ammine aromatiche primarie possono fungere da materiale di partenza per la sintesi di coloranti azoti. Inizialmente, le ammine reagiscono per formare sali di diazonium, che formano i composti per copulazione del tetto (o accoppiamento diazoico).
A causa dell'intenso della sua colorazione, vengono utilizzati nell'industria tessile come materiale di tintura; Ad esempio: metil arancione, marrone 138 diretto, giallo tramonto fcf e ponceau.
Droghe e droghe
Molti farmaci agiscono con agonisti e antagonisti di neurotrasmettitori di ammina naturali. Esempi:
-La clorofeniramina è un antistaminico usato nel controllo dei processi allergici a causa dell'assunzione di alcuni alimenti, febbre da fieno, puntura di insetti, ecc.
-La clorpromazina è un agente sedativo, non induttore del sonno. Allevia l'ansia e viene persino usato nel trattamento di alcuni disturbi mentali.
-L'efedrina e la fenimfedrina sono usate come decongestionanti del tratto respiratorio.
Può servirti: osmolarità-Amitriptaline e imipramina sono ammine terziarie utilizzate nel trattamento della depressione. Il cono antidepressivo triciclico è classificato dalla loro struttura.
-Analgesici degli oppiacei come morfina, codeline ed eroina sono ammine terziarie.
Trattamento del gas
Diverse ammine, tra cui diglycolamina (DGA) e dietolamina (DEA), sono usate nell'eliminazione dei gas di anidride carbonica (CO2) e idrogeno solforato (H2S) presente in gas naturale e raffinerie.
Chimica agricola
I metilamine sono composti intermedi nella sintesi di sostanze chimiche utilizzate in agricoltura come erbicidi, fungicidi, insetticidi e biocidi.
Resine Manufacturing
Le metilamine vengono utilizzate durante l'elaborazione delle resine di scambio ionico, utilizzabili nella dionizzazione dell'acqua.
Nutrienti animali
La trimetilammina (TMA) è utilizzata principalmente nella produzione di cloruro di cloruro, un integratore di vitamina B utilizzato in polli, tacchini e suini.
Industria della gomma
L'olio di dimetilammina (DMA) è un emulsionante per l'uso nella produzione di gomma sintetica. DMA viene usato direttamente come modificatore di polimerizzazione nella fase a vapore del butadiene e come stabilizzatore del lattice di gomma naturale anziché l'ammoniaca
Solventi
La dimetilammina (DMA) e la monometilammina (MMA) sono usate per sintetizzare i solventi polari polari polari (DMF), dimetilacetamide (DMAC) e N-metilpirrolidone (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP).
Tra le applicazioni DMF, includono: rivestimento di uretano, solvente per filato acrilico, solventi di reazione e solventi di estrazione.
Il DMAC viene utilizzato nella produzione di coloranti e solventi del filato. Infine, NMP viene utilizzato nella raffinazione di oli lubrificanti, prelievo e rivestimento smaltato.
Esempi di ammine
Cocaina
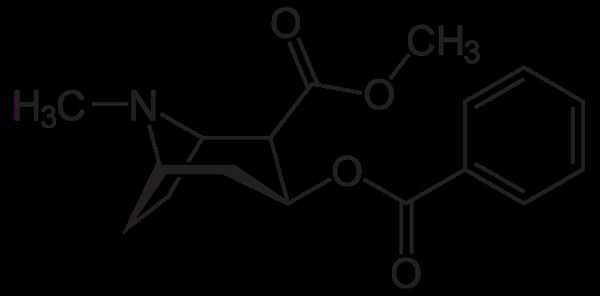 Molecola di cocaina. Neurotokeker, Wikimedia Commons
Molecola di cocaina. Neurotokeker, Wikimedia Commons La cocaina è usata come anestetico locale in alcuni tipi di chirurgia oculare, orecchie e gola. Come visto, è un'ammina terziaria.
Nicotina
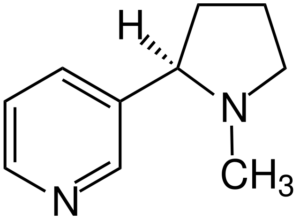 Molecola di nicotina. Fonte: Jü [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons
Molecola di nicotina. Fonte: Jü [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons La nicotina è l'agente principale della dipendenza da tabacco e chimicamente un'ammina terziaria. La nicotina presente nel fumo di tabacco viene assorbita rapidamente ed è altamente tossica.
Morfina
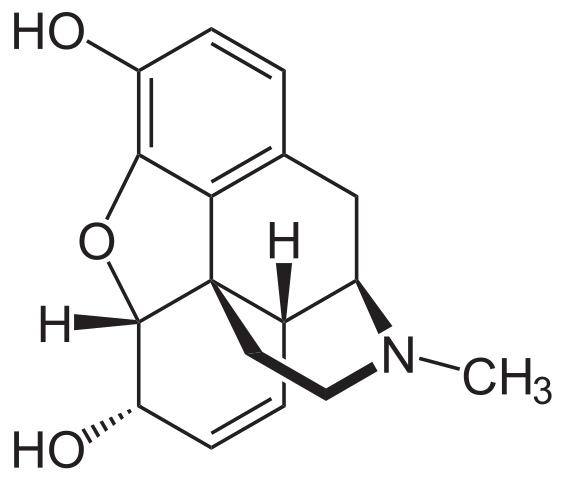 Molecola di morfina. Fonte: Neurotoger [dominio pubblico], di Wikimedia Commons
Molecola di morfina. Fonte: Neurotoger [dominio pubblico], di Wikimedia Commons È uno degli analgesici più efficaci per alleviare il dolore, in particolare il cancro. È, ancora una volta, un'ammina terziaria.
Serotonina
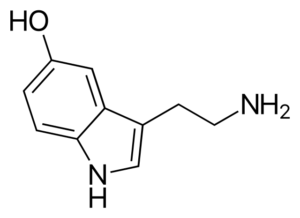 Molecola di serotonina. Fonte: Harbin [Dominio pubblico], di Wikimedia Commons
Molecola di serotonina. Fonte: Harbin [Dominio pubblico], di Wikimedia Commons La serotonina è un neurotrasmettitore di ammina. Nei pazienti depressi la concentrazione del principale metabolita della serotonina è ridotta. A differenza delle altre ammine, questo è primario.
Riferimenti
- Metilammine: usi e applicazioni. Recuperato da: Chemours.com
- Ricerche di mercato della trasparenza. (S.F.). Ammine: fatti e usi importanti. Recuperato da: TransparencyMarkeTresearch.com

