Aspetti generali, funzioni ed esempi generali di alosterismo

- 1039
- 163
- Silvano Montanari
Lui Alosterismo o La regolazione alostrica è definita come il processo di inibizione o attivazione di un enzima mediato da una molecola regolatoria diversa dal suo substrato e agisce in un sito specifico della sua struttura, diverso dal sito attivo dello stesso.
Il termine "alosterico" o "alosterismo" proviene dalle radici greche "Allos ", che significa "un altro" e "Stereós", che significa "forma" o "luogo"; Quindi letteralmente si traduce come "altro spazio", "un altro posto" o "un'altra struttura".
 Schema grafico di una regolamentazione teosterica. (A) Sito attivo. (B) Sito alosterico. (C) substrato. (D) inibitore. (E) enzima. (Fonte: Isaac Webb [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Schema grafico di una regolamentazione teosterica. (A) Sito attivo. (B) Sito alosterico. (C) substrato. (D) inibitore. (E) enzima. (Fonte: Isaac Webb [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) Alcuni autori descrivono l'alosterismo come un processo attraverso il quale i siti remoti in un sistema (la struttura di un enzima, per esempio) sono energicamente accoppiati per produrre una risposta funzionale, motivo per cui si può presumere che un cambiamento in una regione possa influenzare qualsiasi altra nello stesso.
Questo tipo di regolazione è tipico degli enzimi che partecipano a più processi biologici noti, come la trasduzione del segnale, il metabolismo (anabolismo e catabolismo), la regolazione dell'espressione genetica, tra gli altri.
Le prime idee sull'alosterismo e la loro partecipazione al controllo del metabolismo cellulare furono postulate negli anni '60 da F. Monodo, f. Jacob e J. Changeux, mentre studiano le rotte biosintetiche di diversi aminoacidi, che sono stati inibiti dopo l'accumulo dei prodotti finali.
Sebbene la prima pubblicazione a questo proposito avesse a che fare con la regolazione genetica, poco tempo dopo Monod, Wyman e Changeux hanno ampliato la concezione dell'alosterismo alle proteine con attività enzimatica e ha proposto un modello basato su proteine multimeriche, principalmente supportate dalle interazioni tra le subunità quando qualsiasi di questi si unì a un effettore.
Può servirti: Guanina: caratteristiche, struttura, formazione e funzioniMolti dei concetti successivi avevano le loro basi nella teoria del "aggiustamento indotto" introdotto da Koshland qualche anno prima.
[TOC]
Caratteristiche generali
In generale, tutti gli enzimi hanno due siti diversi per l'Unione dei ligandi: uno è noto come sito attivo, che si unisce alle molecole che funzionano come substrato (responsabile dell'attività biologica dell'enzima) e l'altro è l'altro come teosterico Sito, che è specifico per altri metaboliti.
Questi "altri metaboliti" sono chiamati effettori areestrici e possono avere effetti positivi o negativi sulla velocità delle reazioni catalizzate dagli enzimi o nell'affinità con cui si uniscono ai loro substrati nel sito attivo.
Di solito, l'unione di un effettore su AL, un sito enzimatico provoca un effetto su un altro sito della struttura, modificando la sua attività o prestazioni funzionali.
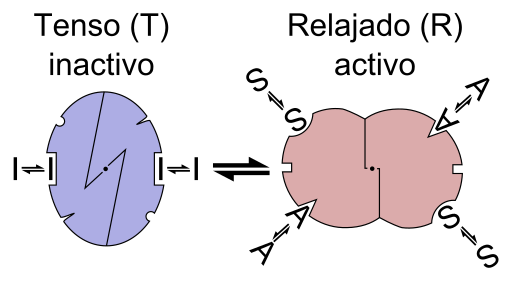 Schema grafico della reazione di un enzima Alosterica (Fonte: File: Enzima Allostery è.PNG: File: Enzyme Allostery.PNG: Allostery.PNG: Nicolas Le Novere (talk).Lenov a in.WikipediaDerivative Work: Timvices (talk) Derivative Work: Retama (talk) Derivative Work: Kes47 [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons)
Schema grafico della reazione di un enzima Alosterica (Fonte: File: Enzima Allostery è.PNG: File: Enzyme Allostery.PNG: Allostery.PNG: Nicolas Le Novere (talk).Lenov a in.WikipediaDerivative Work: Timvices (talk) Derivative Work: Retama (talk) Derivative Work: Kes47 [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons) In altre parole, l'unione di un effettore di Alestro nel suo luogo specifico nella struttura di un enzima provoca un cambiamento nella geometria molecolare dell'enzima, che è noto come transizione verso il teosterico, cioè è un evento che viene trasmesso Durante la macromolecola, modificando il suo comportamento.
L'alosterismo può essere omotropico o eterotropico. Un processo di regolazione alostroica omotropica è definito come quello in cui lo stesso substrato di un enzima agisce come regolatore alestic, cioè che l'effettore alosterico è lo stesso substrato; È anche noto come un tipo di cooperativo.
Un processo di regolazione eterotropica, d'altra parte, si riferisce alla regolazione dell'attività di un enzima mediato da una molecola o effettore del teosterico che è diverso dal suo substrato e può anche avere effetti positivi o negativi sull'attività dell'enzima.
Può servirti: aptenia cordifolia: caratteristiche, habitat, proprietà, coltivazioneFunzioni
L'alosterismo, insieme alla regolazione dell'espressione genetica, della traduzione e della degradazione delle proteine, è uno dei meccanismi fondamentali per la regolazione di un gran numero di processi organici, che è essenziale per il mantenimento dell'omeostasi e per la sopravvivenza tutti viventi, unicellulari o multicellulari esseri.
La regolazione o l'alosterismo toostale dà agli organismi viventi la capacità di rispondere con grande sensibilità ai cambiamenti nella concentrazione di ligandi regolatori, nonché a quello di origine ritmica a livello cellulare.
Poiché i substrati energetici e metabolici sono limitati in una cellula, l'alosterismo consente, nel campo metabolico, l'uso moderato delle risorse, evitando sia i cicli inutili che lo spreco di energia per l'eccessiva elaborazione dei substrati in condizioni di abbondanza o di carenza.
Allo stesso modo, questo meccanismo di regolazione è di grande importanza per i processi di segnalazione cellulare, in cui sono coinvolti molti cambiamenti conformazionali che sono innescati dall'unione di diversi ligandi in siti specifici dei recettori in questione.
Esempi di alosterismo
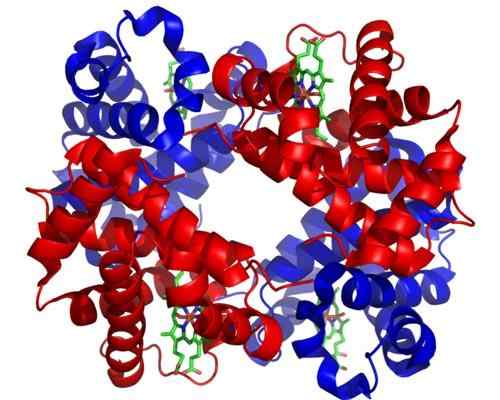 Emoglobina. Preso e curato da: Zephyris at the English Language Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]].
Emoglobina. Preso e curato da: Zephyris at the English Language Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Sebbene ci siano migliaia di esempi di toosterismo o regolamentazione alla natura, alcuni sono stati più importanti di altri. Questo è il caso dell'emoglobina, che era una delle prime proteine descritte in profondità nell'aspetto strutturale.
L'emoglobina è una proteina molto importante per molti animali, in quanto è responsabile del trasporto di ossigeno attraverso il sangue dai polmoni ai tessuti. Questa proteina presenta omotropica ed eterotropica alla regolazione teosterica allo stesso tempo.
Può servirti: saltacionismo: caratteristiche, prove ed esempiL'alosterismo omotropico dell'emoglobina ha a che fare con l'unione di una molecola di ossigeno in una delle subunità che lo compongono influisce direttamente sull'affinità con cui la subunità adiacente a un'altra molecola di ossigeno è vincolante, aumentando la regolazione positiva o di cooperazione).
Eterotropico a eterotropico
L'alosterismo eterotropico, d'altra parte, è correlato agli effetti sia del pH che della presenza di 2,3-diffoglicerato sull'unione di ossigeno alle subunità di questo enzima, inibendolo.
La transcarbamilasi o l'Atcasa aspartato, che partecipa alla via della sintesi della pirimidina, è anche uno degli esempi "classici" di regolamentazione alosterica. Questo enzima, che ha 12 subunità, di cui 6 sono cataliticamente attivi e 6 sono regolatori, è inibito eterotropicamente dal prodotto finale della rotta che si dirige, il citidininatrifosfato (CTP).
Operone di lattosio E. coli
Il frutto delle prime idee di monod, Jacob e Changeaux è stato un articolo pubblicato da Giacobbe e monode legati al lattosio del lattosio del lattosio di Escherichia coliYo, che è uno dei tipici esempi di regolazione eterotropica a livello genetico.
La regolazione toostale di questo sistema non è correlata alla capacità di convertire un substrato in un prodotto, ma all'affinità dell'unione di una proteina nella regione del DNA operativa.
Riferimenti
- Changeux, J. P., & Edelstein, s. J. (2005). Meccanismi allosterici di trasduzione del segnale. Science, 308 (5727), 1424-1428.
- Goldbeter, a., & DuPont, G. (1990). Regolamento allosterico, cooperazione e oscillazioni biochimiche. Chimica biofisica, 37 (1-3), 341-353.
- Jiao, w., & Parker, e. J. (2012). Utilizzando una compinazione di tecniche computazionali e sperimentali per comprendere le basi molecolari per l'allosteria delle proteine. In progressi nella chimica delle proteine e nella biologia strutturale (Vol. 87, pp. 391-413). Academic Press.
- Kern, d., & Zuiderweg, e. R. (2003). Il ruolo delle dinamiche nella regolamentazione allosterica. Opinione attuale in biologia strutturale, 13 (6), 748-757.
- Laskowski, r. A., Gerick, f., & Thornton, J. M. (2009). Le basi strutturali della regolazione allosterica nelle proteine. Febs Letters, 583 (11), 1692-1698.
- Mathews, c. K., Van Holde, K. E., & Ahern, K. G. (2000). Biochimica, ed. San Francisco, California.
- « Struttura dei nanotubi di carbonio, proprietà, applicazioni, tossicità
- Processo di radiazione adattiva, tipi ed esempi »

