Aldeide

- 2745
- 770
- Dante Morelli
Quali sono le aldeidi?
IL aldeide Sono composti organici che hanno una formula generale RCHO. R rappresenta una catena alifatica o aromatica; C Carbon; O ossigeno e idrogeno H. Sono caratterizzati dal possesso di un gruppo carbonilico, come chetoni e acidi carbossilici, quindi le aldeidi sono anche chiamate composti carbonilici.
Il gruppo carbonile dà all'aldeide molte delle sue proprietà. Sono composti che sono facilmente ossidati e molto reattivi alle aggiunte nucleofile. Il doppio legame del gruppo carbonilico (C = O) presenta due atomi che hanno differenze nella loro avidità da parte degli elettroni (elettronegatività).
L'ossigeno attira gli elettroni più fortemente del carbonio, quindi la nuvola elettronica si muove verso di essa facendo il doppio legame tra carbonio e ossigeno della natura polare, con un importante momento di dipolo. Questo rende l'aldeide.
In altre parole, le aldeidi sono un tipo di composti organici derivanti dall'ossidazione di determinati alcoli.
Struttura chimica degli aldeidi
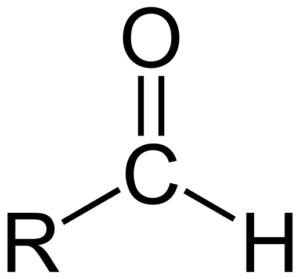 Struttura chimica degli aldeidi
Struttura chimica degli aldeidi Gli aldeidi sono costituiti da un carbonile (c = o) a cui un atomo di idrogeno è direttamente collegato. Questo lo differenzia da altri composti organici, come i chetoni (R2C = o) e acidi carbossilici (rcooh).
L'immagine superiore mostra la struttura molecolare attorno al formil -cho, di gruppo. Il gruppo formato è piatto perché il carbonio e l'ossigeno hanno ibridazione SP2. Questa planarità la rende suscettibile all'attacco delle specie nucleofili e quindi è facilmente ossidata.
Cosa significa tale ossidazione? Alla formazione di un legame con qualsiasi altro atomo più elettronegativo del carbonio; E nel caso di aldeide è un ossigeno. Pertanto, l'aldeide ossida un acido carbossilico, -COH. E se l'Aldeide fosse ridotta? Si formerebbe invece un alcol primario, ROH.
Aldeidi si verificano solo da alcoli primari: quelli in cui il gruppo OH è alla fine di una catena. Allo stesso modo, il gruppo Formil Sempre È alla fine di una catena o si distingue da essa o dall'anello come sostituente (se ci sono altri gruppi più importanti, come -cooh).
Proprietà fisiche e chimiche delle aldeidi
Essendo composti polari, i loro punti di fusione sono maggiori di quelli dei composti non polari. Le molecole di aldeidi non sono in grado di legarsi in modo intermolecolare con i ponti idrogeno, per avere solo atomi di carbonio uniti agli atomi di idrogeno.
A causa di quanto sopra, le aldeidi hanno punti di ebollizione più bassi rispetto agli alcoli e agli acidi carbossilici.
Punti di fusione
Formaldeide -92; Acetaldeide -121; Propionaldeide -81; n- butiraldeide -99; N -valeraldeide -91; Caproaldeide -; Eptaldeide - 42; Fenilacetaldeide -; Benzaldeide -26.
Punti bollenti
Formaldeide -21; Acetaldeide 20; Propional Ofhyd 49; N-butiraldehido 76; N-Valeldeide 103; Caproaldeide 131; Eptaldeide 155; Fenilacetaldeide 194; Banzaldeide 178.
Può servirti: proprietà specifiche della materia: cosa sono ed esempiSolubilità dell'acqua espressa in g/100 g di H2O
Formaldeide, molto solubile; acetaldeide, infinito; Propionaldeide, 16; N-butiraldeide, 7; N-Valeldeide, leggermente solubile; Caproaldeide, leggermente solubile; Fenilacetaldeide leggermente solubile; Benzaldeide, 0,3.
I punti di ebollizione degli aldeidi tendono ad aumentare direttamente con il peso molecolare. Al contrario, c'è la tendenza a ridurre la solubilità delle aldeidi in acqua all'aumentare del loro peso molecolare. Ciò si riflette nelle costanti fisiche delle nuove aldeidi menzionate.
Reattività degli aldeidi
Reazione di ossidazione
Le aldeidi possono ossidare l'acido carbossilico corrispondente in presenza di uno di questi composti: AG (NH3)2, Kmno4 Va bene2Cr2O7.
Riduzione agli alcoli
Possono idrogeno se stessi con l'aiuto di catalizzatori di nichel, platino o paladio. Pertanto, C = O si trasforma in C-OH.
Riduzione agli idrocarburi
In presenza di Zn (Hg), HCl concentrato o in NH2NH2 Gli aldeidi perdono il gruppo carbonilico e diventano idrocarburi.
Aggiunta nucleofila
Ci sono diversi composti che vengono aggiunti al gruppo carbonilico, tra cui: Grignard, reagenti di cianuro, derivati dell'ammoniaca e alcoli.
Nomenclatura degli aldeidi
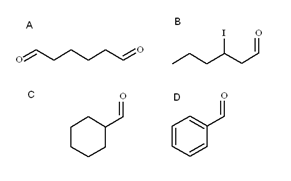 Quattro aldeidi. Fonte: Gabriel Bolívar
Quattro aldeidi. Fonte: Gabriel Bolívar Nell'immagine superiore sono illustrate quattro aldeidi. Come vengono nominati?
Poiché sono alcoli primari arrugginiti, il nome dell'alcol viene cambiato la terminazione -ol di -al. Quindi, metanolo (scegli3Oh) se ossidato a CHO3Cho è chiamato metanale (formaldeide); Cap3Cap2Cho etatanal (acetaldeide); Cap3Cap2Cap2Cho propanal e cho3Cap2Cap2Cap2Butanal Cho.
Tutti gli aldeidi di recente nome hanno il gruppo -cho alla fine della catena. Quando questo è ad entrambe le estremità, come in A, alla fine, il prefisso di gli viene aggiunto-. Come ha sei carboni (contando quelli di entrambi i gruppi formyl), deriva da 1-esanolo e il suo nome è quindi: esanocomporre.
Quando c'è un sostituente, come un radicale alquilico, un collegamento doppio o triplo o un alogeno, i carboni della catena principale sono elencati dando il numero 1. Pertanto, l'aldeide B è chiamato: 3-inithexanal.
Tuttavia, nelle aldeidi c e d il gruppo -cho non ha priorità per identificare questi composti di altri. C è un cicloalcano, mentre D un benzene, entrambi con uno dei suoi h sostituiti da un gruppo formil.
In essi, poiché la struttura principale è ciclica, il gruppo formil è chiamato carbaldeide. Pertanto, C è il cicloesanocbaldeide e d la benzenocarbodeide (meglio conosciuta come benzaldeide).
Usi di aldeidi
Ci sono aldeidi nella natura in grado di conferire sapori piacevoli, tale è il caso della cannamaldeide, responsabile del sapore caratteristico della cannella. Ecco perché vengono solitamente usati come aromi artificiali in molti prodotti, come dolci o cibo.
Formaldeide
La formaldeide è l'aldeide che si verifica industrialmente in maggiore quantità. La formaldeide ottenuta dall'ossidazione del metanolo viene utilizzata in una soluzione al 37% di gas in acqua, sotto il nome di formalina. Questo è usato nell'abbronzatura delle pelli e nella conservazione e nell'imbalsamazione dei cadaveri.
Può servirti: acetato di sodio: struttura, proprietà, sintesi, usiLa formaldeide è anche usata come germicida, fungicida e insetticida per piante e verdure. Tuttavia, la sua più grande utilità è il contributo alla produzione di materiale polimerico. La plastica chiamata Bakelita è sintetizzata dalla reazione tra la formaldeide e il fenolo.
Bakelita
Bakelita è un ottimo polimero a struttura dimensionale che è un ottimo polimero usato in numerosi utensili domestici, come vasi di pentole, padelle, caffè, coltelli, ecc.
I polimeri simili alla bakelita sono realizzati in formaldeide in combinazione con i composti di urea e melamina. Questi polimeri sono usati non solo come materie plastiche, ma sono anche usati come bastoncini adesivi e materiale di rivestimento.
Compensato
Il compensato è il nome commerciale di un materiale formato da sottili fogli di legno, uniti da polimeri prodotti dalla formaldeide. I marchi formici e melmac sono fabbricati con la partecipazione di questo. Il formico è un materiale plastico utilizzato nel rivestimento di mobili.
La plastica MMLMAC viene utilizzata nell'elaborazione di piastre, bicchieri, tazze, ecc. La formaldeide è materia prima per la sintesi del composto di metilene-difenil-diisociato (MDI), precursore del poliuretano.
Poliuretano
Il poliuretano viene utilizzato come isolante in frigoriferi e congelatori, imbottiti per mobili, materassi, rivestimenti, adesivi, suole, ecc.
Butiraldeide
Butiraldeide è il precursore principale per la sintesi di 2-etilhexanolo, che viene utilizzato come plastificante. Ha un piacevole aroma di mela che consente il suo uso nel cibo come aroma.
Viene anche utilizzato per gli acceleratori di gomma. Interviene come un reagente intermedio nella produzione di solventi.
Acetaldeide
L'acetaldeide è stata utilizzata nella produzione di acido acetico. Ma questa funzione dell'acetaldeide è diminuita di importanza, poiché è stata sfollata dal processo di carbonilazione del metanolo.
Sintesi
Altre aldeidi sono precursori oxoalcoholi, che sono usati nella produzione di detergenti. Gli oxoalcohole così ricchi di calci vengono preparati aggiungendo carbonio e monossido di idrogeno a un'olefina per ottenere un aldeide. E infine l'aldeide è idrogeno per ottenere alcol.
Alcuni aldeidi sono usati nella produzione di profumi, come il Chanel n. 5. Molte aldeidi naturali hanno odori piacevoli, per esempio: l'eptanica ha l'odore di erba verde; L'ottano, odore di arancione; L'odore non anale di rose e citrali, odore di Lima.
Esempi di aldeidi
Glutaraldeide
 Glutaraldeide. Fonte: di Jynto [CC0], di Wikimedia Commons
Glutaraldeide. Fonte: di Jynto [CC0], di Wikimedia Commons La glutaraldeide si presenta nella sua struttura due gruppi formyl ad entrambe le estremità.
Commercializzato sotto il nome di CIDEX o glutararal, viene utilizzato come disinfettante per sterilizzare gli strumenti chirurgici. È usato nel trattamento delle verruche sui piedi, applicando come liquido.
Viene anche usato come agente di fissaggio in tessuto nei laboratori di istologia e patologia.
Può servirti: solfato di rame (CUSO4): struttura, proprietà, ottenimento, usiBenzaldeide
È l'aldeide aromatica più semplice, che è formata da un anello di benzene in cui un gruppo formil è collegato.
Si trova in olio di mandorle, quindi il suo odore caratteristico che consente il suo uso come aroma di cibo. Inoltre, viene utilizzato nella sintesi di composti organici legati alla produzione di farmaci e elaborazione della plastica.
Gliceraldeide
È un aldotriosa, uno zucchero costituito da tre atomi di carbonio. Presenta due isomeri che sono chiamati d ed enantiomeri. La gliceraldeide è il primo monosaccaride ottenuto in fotosintesi durante la fase oscura (Calvin Cycle).
Gliceraldeide-3-fosfato
 Gliceraldeide. Fonte: Jynto e Ben Mills
Gliceraldeide. Fonte: Jynto e Ben Mills Nell'immagine superiore è illustrata la struttura del gliceraldeide-3-fosfato. Le sfere rosse accanto al giallo corrispondono al gruppo fosfato, mentre nero allo scheletro di carbonio. La sfera rossa legata a Blanca è il gruppo OH, ma quando la sfera nera è collegata e quest'ultima a quella bianca, allora è il gruppo CHO.
Il gliceraldeide-3-fosfato interviene nella glicolisi, un processo metabolico in cui il glucosio è degradato in acido piruvico con la produzione di ATP, un serbatoio di energia degli esseri viventi di esseri viventi. Oltre alla produzione di NADH, un agente di riduzione biologica.
Nella glicoleraldeide-3-fosfato la glicolisi e il fosfato diidroacetone sono causati dal D-Frucease-6-6-Biphary-Fosfato.
Il gliceraldeide-3-fosfato interviene nel processo metabolico noto come ciclo di pentosio. In questo viene generato il NADPH, importante riduttore biologico.
11 -cis -retinal
 11 -cis -retinal
11 -cis -retinal Il β-carotene è un pigmento naturale presente in diverse verdure, specialmente nella carota. Sperimentare una rottura ossidativa nel fegato, trasformando così in alcol retinolo o vitamina A. L'ossidazione della vitamina A e la successiva isomerizzazione di uno dei suoi doppi legami, forma l'aldeide a 11 cis-retinalini.
Fosfato piridossale (vitamina B6)
 Fosfato piridossale o vitamina B6. Fonte: Jynto e Ben Mills.
Fosfato piridossale o vitamina B6. Fonte: Jynto e Ben Mills. È un gruppo protesico attaccato a diversi enzimi, che è la forma attiva della vitamina B6 e partecipa al processo di sintesi del neurotrasmettitore inibitorio GABA.
Dov'è il gruppo formil nella sua struttura? Si noti che ciò differisce dal resto dei gruppi legati all'anello aromatico.
Salicilaldeide
È una materia prima per la sintesi di acido acetilsalicilico, medicina analgesica e antipiretica nota come aspirina.
Riferimenti
- Robert C. Neuman, jr. Capitolo 13, composti carbonilici: chetoni, aldeidi, acidi carbossilici. [PDF]. Tratto da: Chem.Ucr.Edu
- Germán Fernández. (14 settembre 2009). Nomenclatura degli aldeidi. Tratto da: Chemicicaorganica.netto
- T.W. Graham Solomons, Craight B. Frigorifero. Chimica organica. (Decima edizione, p 729-731) Wiley Plus.
- Jerry March e William H. Marrone. (31 dicembre 2015). Aldeide. Preso da: Britannica.com
- Wikipedia. (2018). Aldeide. Tratto da: https: // in.Wikipedia.org/wiki/aldeide
- Morrison, r. T. E boyd, r. N. (1990). Chimica organica quinta edizione. Editoriale Addison-Wesley IberoAmericana.
- Carey, f. A. (2006). Chimica organica sesta edizione. Mc Graw Hill Editoriale.
- Mathews, ch. K., Van Holde, K. E. E Athern, K. G. (2002). Biochimica. Terza edizione. Editoriale Pearson Adisson Wesley.

