Agente di riduzione del concetto, gli esempi più forti

- 1798
- 437
- Ruth Cattaneo
UN agente riducente È una sostanza che svolge la funzione di ridurre un agente ossidante in una reazione di riduzione dell'ossido. Ridurre gli agenti sono donatori di elettroni per natura, in genere sostanze che sono ai loro livelli di ossidazione più bassi e con un'elevata quantità di elettroni.
C'è una reazione chimica in cui variano gli stati di ossidazione degli atomi. Queste reazioni comportano una riduzione complementare e un processo di ossidazione. In queste reazioni, uno o più elettroni di una molecola, atomo o ione vengono trasferiti in un'altra molecola, atomo o ione. Ciò implica la produzione di una reazione di riduzione dell'ossido.

Durante il processo di riduzione dell'ossido, quell'elemento o un composto che perde (o dona) il suo elettrone (o elettroni) è chiamato agente riducente, in contrasto con quell'agente ossidante che è il recettore degli elettroni. Si dice quindi che gli agenti riducenti riducono l'agente ossidante e che l'agente ossidante ossida l'agente riducente.
Gli agenti riducenti migliori o più forti sono quelli che hanno la più grande radio atomica; Cioè, hanno una distanza maggiore dal loro nucleo agli elettroni che circondano lo stesso.
Gli agenti riducenti sono generalmente ioni metallici o negativi. Tra gli agenti riducenti comuni ci sono acido ascorbico, zolfo, idrogeno, ferro, litio, magnesio, manganese, potassio, sodio, vitamina C, zinco e persino estratto di carota.
[TOC]
Cosa stanno riducendo gli agenti?
Come già detto, la riduzione degli agenti è responsabile della riduzione di un agente ossidante quando si verifica una reazione di riduzione dell'ossido.
Una reazione semplice e tipica della reazione di riduzione dell'ossido è quella della respirazione cellulare aerobica:
Può servirti: idruro di alluminio (ALH3): struttura, proprietà, usiC6H12O6(s) + 6o2(g) → 6co2(g) + 6h2O (l)
In questo caso, dove glucosio (c6H12O6) sta reagendo con ossigeno (o2), il glucosio si sta comportando come l'agente riducente per dare elettroni all'ossigeno - cioè viene ossidato - e l'ossigeno diventa un agente ossidante.
In chimica organica, i migliori agenti riducenti sono considerati reagenti che forniscono idrogeno (H2) alla reazione. In questo campo di chimica, la reazione di riduzione si riferisce all'aggiunta di idrogeno a una molecola, sebbene la definizione precedente (si applica anche le reazioni di riduzione dell'ossido.
Fattori che determinano la forza di un agente riducente
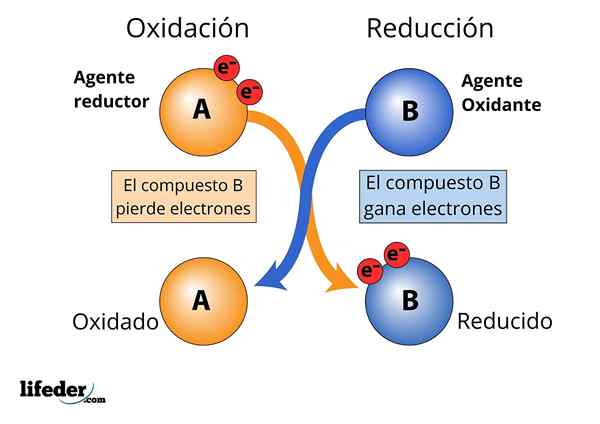 Si osserva l'agente ossidante e riducente, perdite e guadagni elettroni
Si osserva l'agente ossidante e riducente, perdite e guadagni elettroni Affinché una sostanza sia considerata "forte".
Per questo, ci sono una serie di fattori che devono essere presi in considerazione per riconoscere la forza che un agente riducente può avere: elettronegatività, raggio atomico, energia di ionizzazione e potenziale di riduzione.
Elettronegatività
L'elettronegatività è la proprietà che descrive la tendenza di un atomo di attirare un paio di elettroni uniti verso se stessi. Maggiore l'elettronegatività, maggiore è la forza di attrazione esercitata dall'atomo sugli elettroni circostanti.
Nella tavola periodica, l'elettronegatività aumenta da sinistra a destra, quindi i metalli alcalini sono gli elementi meno elettronegativi.
Radio atomica
È la proprietà che misura la quantità di atomi. Si riferisce alla distanza tipica o media del centro di un nucleo atomico al bordo della nuvola elettronica che la circonda.
Può servirti: nitriti: proprietà, struttura, nomenclatura, formazioneQuesta proprietà non è precisa - e inoltre, diverse forze elettromagnetiche sono coinvolte nella sua definizione - ma è noto che questo valore sta diminuendo da sinistra a destra nella tabella periodica e aumenta dall'alto verso il basso. Questo è il motivo per cui i metalli alcalini, in particolare il cesio, sono considerati da una radio più grande atomica.
Energia ionizzata
Questa proprietà è definita come l'energia necessaria per rimuovere l'elettrone meno unito da un atomo (l'elettrone di Valencia) per formare un catione.
Si dice che più gli elettroni siano al nucleo dell'atomo circostante, maggiore è l'energia di ionizzazione dell'atomo.
L'energia di ionizzazione aumenta da sinistra della destra e dal basso verso l'alto nella tabella periodica. Ancora una volta, i metalli (in particolare l'alcalina) hanno meno energia di ionizzazione.
Potenziale di riduzione
È la misura della tendenza di una specie chimica ad ottenere elettroni e, quindi, essere ridotta. Ogni specie ha un potenziale di riduzione intrinseco: maggiore è il potenziale, maggiore è la sua affinità con gli elettroni e anche la sua capacità di essere ridotta.
Ridurre gli agenti sono quelle sostanze con un potenziale di riduzione inferiore, a causa della loro piccola affinità con gli elettroni.
Agenti riducenti più forti
Con i fattori sopra descritti, si può concludere che per trovare un agente "forte" riducente, un atomo o una molecola con bassa elettronegatività, elevato raggio atomico e bassa energia di ionizzazione.
Come già accennato, i metalli alcalini presentano queste caratteristiche e sono considerati gli agenti riducenti più forti.
Può servirti: idrocarburi alifatici: proprietà, nomenclatura, reazioni, tipiD'altra parte, il litio (Li) è considerato l'agente riducente più forte per avere il potenziale di riduzione più basso, mentre la molecola di Lialh4 È considerato l'agente riducente più forte di tutti, per contenere questo e l'altra caratteristiche desiderate.
Esempi di reazioni con agenti riducenti
Ci sono molti casi di riduzione dell'ossido nella vita di tutti i giorni. Di seguito sono riportati alcuni dei più rappresentativi:
Esempio 1
La reazione a combustione dell'ottano (il componente principale della benzina):
2 c8H18(l) + 25o2 → 16co2(g) + 18h2O (g)
Puoi vedere come gli elettroni di ossigeno Dona di ottano (agente riducono) (agente ossidante), formando anidride carbonica e acqua in grandi quantità.
Esempio 2
L'idrolisi del glucosio è un altro utile esempio di riduzione comune:
C6H12O6 + 2ADP + 2p + 2NAD+ → 2ch3NOCE DI COCCO2H + 2ATP + 2NADH
In questa reazione le molecole NAD (un recettore degli elettroni e un agente ossidante in questa reazione) prendono elettroni al glucosio (riducendo l'agente).
Esempio 3
Infine, nella reazione di ossido ferrico
Fede2O3(s) + 2al (s) → a2O3(s) + 2fe (L)
L'agente riducente è in alluminio, mentre l'agente ossidante è il ferro.
Riferimenti
- Wikipedia. (S.F.). Wikipedia. Ottenuto da in.Wikipedia.org
- BBC. (S.F.). BBC.co.UK. Ottenuto da BBC.co.UK
- Pearson, d. (S.F.). Chimica librettexts. Ottenuto da Chem.Librettexts.org
- Ricerca, b. (S.F.). Bodner Research Web. Ottenuto da Murmed.Chimica.Purdue.Edu
- Peter Atkins, L. J. (2012). Principi chimici: la ricerca di Insight.
- « Proprietà di Cassia Angustifolia, preparazione, controindicazioni
- Caratteristiche di proiezione azimutali, tipi, vantaggi, svantaggi »

