Agar Lia (Iron Lysina) Cos'è, Fondazione, preparazione, usi
- 3694
- 506
- Ruth Cattaneo
Lui Agar lia (Lisina di ferro) È un test biochimico utilizzato per l'identificazione dei batteri della famiglia Enterobacteriaceae. Questo mezzo è stato creato da Edwards e Fife, basato sulla formula di Falkow.
Originariamente questo test era un brodo contenente peptoni, estratto di lievito, glucosio, l-lisina, bromocresh e acqua distillata viola. Edwards e Fife hanno aggiunto Agar-Adagar, Citratus ferrico di ammonio e tiosulfato di sodio.
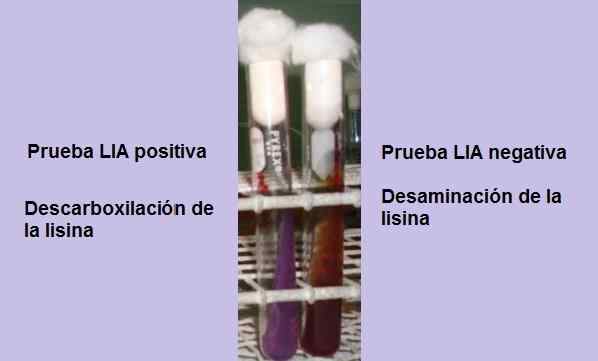
 Test positivo e negativo della decarbossilazione della lisina. Fonte: foto e schema di proprietà dell'autore MSC. Marielsa Gil
Test positivo e negativo della decarbossilazione della lisina. Fonte: foto e schema di proprietà dell'autore MSC. Marielsa Gil Il test consiste fondamentalmente nel dimostrare la presenza dell'enzima rudboxlase, in grado di reagire con il gruppo carbossilico dell'amminoacido L-lisina. Una deaminazione dell'amminoacido può anche verificarsi a causa della presenza del crepacuore enzimatico di lisina.
Inoltre, la composizione del mezzo consente di dimostrare la capacità di alcuni generi batterici di produrre idrogeno solforato. Infine, è anche possibile osservare la generazione o meno del gas nel mezzo.
Base
Peptonas ed estratto di lievito
Come la maggior parte dei terreni coltivati, l'agar di ferro lisina contiene componenti che forniscono la fonte nutritiva necessaria per la crescita batterica. Questi componenti sono rappresentati da peptones ed estratto di lievito.
Glucosio
Allo stesso modo, questo agar contiene come glucosio carboidrato fermentabile. È noto che tutti i batteri della famiglia Enterobacteriaceae fermentano il glucosio.
Questo passaggio è cruciale, perché sarà incaricato di acidificare l'ambiente, una condizione indispensabile per l'enzima lisina decarbossilasi - se è presente - agisce sul suo substrato.
In alcuni generi batterici, si può osservare la produzione di gas a causa della fermentazione del glucosio.
Il gas è evidenziato quando uno spostamento dell'agar Occ.
Può servirti: biomaterialiL-Lisina
Una volta che la lisina viene decarbossilata, si forma una diamellina (cadaverina) e l'anidride carbonica.
Discallazione si verifica in presenza del coenzima fosfato piridossale. Questa reazione è irreversibile.
Indicatore del pH (Bromocresol Purple)
Tutte le variazioni di pH si sono verificate nel mezzo dalle varie reazioni, sono rilevati dall'indicatore del pH di bromocresol.
In questo senso, quando c'è acidificazione, il mezzo diventa giallo e quando c'è alcalizzazione il mezzo ritorna al colore viola o viola originale.
Quando si verifica il crepacuore della lisina a causa della presenza della lisina enzimatica, si forma un colore rossastro sulla superficie, tipica nella proteica, nella provvidenza e in alcune specie di Morganella.
Ciò è dovuto al fatto che durante il processo di disinvoltura si forma l'acido alfa-zo-carbonico, che reagisce con il citrato di ammonio in presenza di ossigeno, che provoca il colore di cui sopra.
Citrato ferrico di ammonio e tiosulfato di sodio
D'altra parte, i batteri che producono idrogeno solforato saranno prove2S.
I batteri che hanno l'enzima di tiosolfato ridotto hanno la capacità di agire riducendo l'attuale tiosolfato di sodio, formando solfito e idrogeno solforato (H2S).
Quest'ultimo è un gas incolore, ma quando reagisce con il sale di ferro forma solfuro metallico, che è un composto insolubile (precipitato nero visibile).
Tuttavia, la capacità di allenamento di H2S con questo mezzo non è molto affidabile, perché alcuni batteri negativi di decarbossilasi in grado di produrre h2S non formerà il precipitato nero, perché l'acidità del mezzo interferisce. Pertanto si consiglia di confermare con altri mezzi contenenti ferro.
Può servirti: neuroniInterpretazione del test
Ricbossilazione della lisina
I tubi devono essere letti dopo aver completato 24 ore di incubazione, altrimenti esiste il rischio di fraintendere la reazione, riportando falsi negativi.
Ricorda che la prima reazione che si verificherà sarà la fermentazione del glucosio, quindi tutti i tubi dopo 10-12 ore diventeranno gialli.
Se alla fine del tempo di incubazione (24 ore) c'è uno sfondo giallo con una superficie viola o viola, la reazione è negativa. Il colore viola della superficie corrisponde all'alcalizzazione del mezzo mediante l'uso di peptone.
Una reazione positiva è che in cui il fondo e la superficie del tubo sono completamente viola, cioè torna al colore originale.
Pertanto, chi determina la positività del test è la base o il fondo del mezzo. Se hai dubbi sul colore, può essere confrontato con un tubo Lia non inoculato.
Deaminazione della lisina
Un tubo che mostra il crepacuore della lisina avrà una superficie rossastra di granato e uno sfondo giallo (acido) o l'intero tubo rossastro granato.
Questa reazione è interpretata come negativa per la decarbossilazione della lisina, ma positiva per la deaminazione della lisina.
Questa reazione è definita e interpretata nello smusso.
Produzione di idrogeno solforato (H2S)
Una reazione positiva è osservata dall'aspetto di un precipitato nero nel mezzo o parte di esso. Generalmente tra il liml della cornice e la base.
Se il precipitato si verifica in tutto il tubo, non si vedrà le altre reazioni che si verificano al centro.
Registrazione dei risultati
Quando si interpretano il test, i risultati vengono registrati come segue:
Può servirti: Miller e Urey ExperimentPrima viene letta la cornice, quindi lo sfondo o il taco, quindi la produzione di H2S, e infine la produzione di gas.
Esempio: k/a + (-). Questo significa:
- K: cornice alcalina (colore viola)
- A: Sfondo acido (giallo), cioè reazione di decarbossilazione negativa e crepacuore negativo.
- +: Produzione di idrogeno solforato
- (-): senza gas.
Preparazione
Pesare 35 gr del ferro disidratato medio disidratato e dissolversi in un litro di acqua distillata.
Caldo fino a quando non ha completamente disciolto l'agar, per bollire per un minuto agitando frequentemente. Distribuire 4 ml del mezzo in tubi di prova 13/100 con coperchio di cotone.
Sterilizzare in autoclave a 121 ° C per 15 minuti. Rimuovere dall'autoclave e lasciarsi inclinare, in modo che ci sia una base profonda e un breve smusso.
Conservare in un frigorifero di 2-8 ° C. Lascia un carattere prima di seminare la tensione batterica.
Il colore del mezzo disidratato è beige e il mezzo viola rossastro preparato.
Il pH finale del mezzo preparato è 6,7 ± 0.2
Il mezzo diventa giallo con pH pari o inferiore a 5,2 ed è viola a pH 6,5 su.
Applicazioni
Questo test, insieme ad altri test biochimici, viene utilizzato per l'identificazione dei bacilli della famiglia Enterobacteriaceae.
Il mezzo viene seminato con un ago dritto o ago, una o due forature vengono effettuate sul fondo del tubo, quindi la superficie del mezzo in zigzag è rimasta.
È incuba per 24 ore a 35-37 ° C in aerobiosi. Se necessario, viene lasciato incubare per 24 ore in più.
È principalmente utile per differenziare le specie di citrobacter negative da Salmonellas sp.
Riferimenti
- Mac Faddin J. (2003). Test biochimici per l'identificazione dei batteri dell'importanza clinica. 3a ed. PAN -American Editoriale. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnosi microbiologica di Bailey e Scott. 12 ed. Pan -American Editoriale S.A. Argentina.

