Struttura acrilonitrile, proprietà, produzione, usi

- 3693
- 152
- Lidia Valentini
Lui acrilonitrile È un composto organico la cui formula condensata è Cho2Chcn. È uno dei nitrili più semplici che esistono. Chimica e strutturalmente non è altro che il prodotto dell'Unione tra un gruppo di vinile, Cho2= CH- e un nitrile, gruppo cianuro, C /n. È una sostanza con grande impatto industriale sul mondo della plastica.
Fisicamente, è un liquido incolore, con un certo odore di cipolla e quello in stato impuro presenta toni giallastri. È altamente infiammabile, tossico e forse cancerogeno, quindi è classificato come una sostanza estremamente pericolosa. Ironia della sorte, con esso sono materiali di plastica e giocattoli della vita quotidiana, come tupperware e blocchi LEGO.
 I polimeri acrilonitrili sono presenti nella plastica Tupperware. Fonte: Stebulus via Wikipedia.
I polimeri acrilonitrili sono presenti nella plastica Tupperware. Fonte: Stebulus via Wikipedia. A Scales industriali, acrilonitril. Quasi tutta la quantità prodotta è destinata alla fabbricazione di materie plastiche, basata su omopolimeri, come il poliacrilonitrile o in copolimeri, come l'acido-butadiene-stirene.
[TOC]
Struttura acrilonitrile
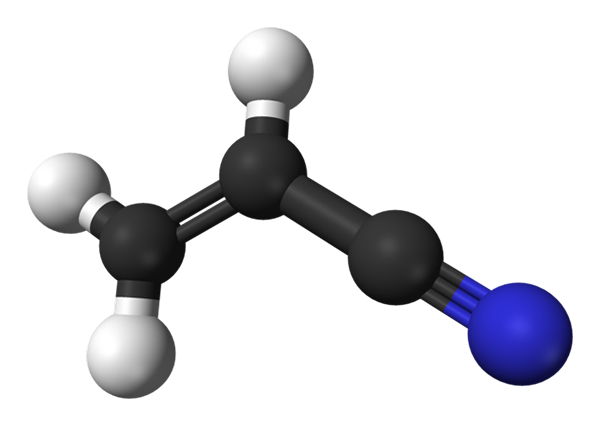 Struttura molecolare di acrilonitrile. Fonte: Benjah-BMM27 / Dominio pubblico
Struttura molecolare di acrilonitrile. Fonte: Benjah-BMM27 / Dominio pubblico Nell'immagine superiore abbiamo la molecola acrilonitrile rappresentata con un modello di sfere e barre. Le sfere nere corrispondono agli atomi di carbonio, mentre gli atomi di bianco e blu a idrogeno e azoto, rispettivamente. La sinistra, ch2= CH- corrisponde al gruppo vinile e a destra, al gruppo cyano, C /n.
L'intera molecola è piatta, perché i carboni del gruppo in vinile hanno ibridazione SP2. Nel frattempo, il gruppo Ciano Carbon ha l'ibridazione SP, essendo accanto all'atomo di azoto in una linea che poggia sullo stesso piano del resto della molecola.
Il gruppo CN contribuisce alla polarità alla molecola, quindi la molecola Cho2CHCN stabilisce un dipolo permanente in cui la densità elettronica più alta è diretta verso l'atomo di azoto. Pertanto, dipolo-dipol.
Può servirti: cos'è la periodicità chimica?Le molecole ch2I CHCN sono piatti, essendo in grado di aspettarsi che nei loro cristalli (solidificati a -84 ºC) siano disponibili l'uno sull'altro come fogli o fogli di carta, in modo che i loro dipoli non si respingano.
Proprietà
Aspetto fisico
Liquido incolore ma con toni giallastri quando presenta alcune impurità. Quando è così, consigliano di distinguerlo prima del suo utilizzo. È volatile e ha anche un odore intenso simile alla cipolla.
Massa molare
53.064 g/mol
Punto di fusione
-84 ºC
Punto di ebollizione
77 ºC
punto d'infiammabilità
-5 ºC (tazza chiusa)
0 ºC (tazza aperta)
Temperatura di autorezione
481 ºC
Densità
0,81 g/cm3
Densità del vapore
1.83 in relazione all'aria.
Pressione del vapore
109 mmHg a 25 ºC
Solubilità
In acqua ha una solubilità da 74 g/L a 25 ºC. Acrilonitrile è anche considerevolmente solubile in acetone, petrolio, etanolo, acetato etilico e benzene etanile.
Decomposizione
Quando rilascia termicamente l'idrogenide tossico, ossidi di carbonio e ossidi di azoto.
Produzione
Processo di sohio
L'acryonitrile può verificarsi su scale massicce attraverso numerose reazioni e processi chimici. Di tutti loro, il processo di Sohio è il più utilizzato, che consiste nell'amaxidazione catalitica del propilene. In un reattore a letto fluidizzato, il propilene viene miscelato con aria e ammoniaca a una temperatura di circa 400 e 510 ºC, dove reagiscono su catalizzatori solidi.
I reagenti entrano nel reattore una volta, che si svolgono la seguente reazione:
2ch3−ch = ch2 + 2 NH3 + 3 o2 → 2 ch2= CH-CESSO + 6 H2O
Si noti che l'ossigeno è ridotto in acqua, mentre il propilene ossida acrilonitrile. Da qui il nome "amoxidazione", perché è un'ossidazione che prevede la partecipazione dell'ammoniaca.
Può servirti: ebollizione: concetto, tipi ed esempiProcessi alternativi
Oltre al processo di Sohio, si possono menzionare altre reazioni che consentono l'ottenimento di acrilonitrile. Ovviamente, non tutti sono scalabili, o almeno in modo sufficiente redditizio, né generano prodotti con alte prestazioni o purezza.
L'acrilonitrile è sintetizzato, sempre dal propilene, ma facendolo reagire con ossido nitrico sui catalizzatori PBO2-Zro2 Airgel -a forma di Airgel. La reazione è la seguente:
4 ch3−ch = ch2 + 6 No → 4 Cho2= CH-CESSO + 6 H2O + n2
Una reazione che non coinvolge il propilene è quella che inizia con l'ossido di etilene, che reagisce con l'idrogeno cianuro per trasformarsi in etilene cianoidrina; E più tardi, diventa disidratato a una temperatura di 200 ºC nell'Acrilonitrile:
ETO + HCN → CH2Ohch2Cn
Cap2Ohch2CN + Q (200 ºC) → CH2= CH-CESSO +H2O
Un'altra reazione molto più diretta è l'aggiunta di idrogeno cianuro sull'acetilene:
HC≡CH + HCN → CH2= CH-CESSO
Tuttavia, si formano molti prodotti secondari, quindi la qualità dell'aciditrile è inferiore rispetto a quella del processo di Sohio.
Oltre alle sostanze sopra menzionate, lattonitrile, propionitril.
Applicazioni
 I Legos sono fabbricati principalmente con plastica ABS, un copolimero in cui fa parte Arilonitrile. Fonte: pxhere.
I Legos sono fabbricati principalmente con plastica ABS, un copolimero in cui fa parte Arilonitrile. Fonte: pxhere. Acrilonitrile è una sostanza indispensabile per l'industria delle materie plastiche. Molte delle sue materie plastiche derivate sono molto conosciute. Questo è il caso dei copolimeri acrilonitrilo-butadiene-stirene (ABS), con i quali sono fabbricati i pezzi dei laici. Abbiamo anche fibre acriliche, elaborate con l'omopolimero poliacrilonitrile (PAN).
Può servirti: saponificazioneTra le altre materie plastiche che contengono acrilonitrile come monomero, o che dipendono da esso per la sua produzione, abbiamo: Acrylene Stretch (SAN), Butadiene acrilonitrile (NBR), acrilato acrilato acrilonitrile (ASA), poliacrilammide e rubine.
Praticamente, qualsiasi polimero naturale, come il cotone, può essere modificato incorporando le sue strutture molecolari in acrilonitrile. Pertanto, si ottengono derivati di nitrile, il che rende la chimica dell'acrilonitrile molto ampio.
Uno dei suoi usi al di fuori del mondo della plastica è come il pesticida mescolato con tetracloruro di carbonio. Tuttavia, a causa del suo terribile impatto sull'ecosistema marino, tali pesticidi si sono vietati o sono soggetti a forti restrizioni.
Rischi
Acrilonitrile è una sostanza pericolosa, quindi deve essere manipolata con cure estreme. Qualsiasi esposizione inappropriata o eccessivamente prolungata a questo composto può essere letale, per inalazione, assunzione o contatto fisico.
Dovrebbe essere mantenuto il più possibile da qualsiasi fonte di calore, poiché è un liquido volatile e molto infiammabile. Né dovrebbe essere in contatto con l'acqua, perché reagisce violentemente con lei.
Oltre a ciò, è forse una sostanza cancerogena, che è stata associata a tumori epatici e polmonari. Coloro che sono stati esposti a questa sostanza hanno aumenti dei livelli di tiocianato escreti nelle urine e cianide nel sangue.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10a edizione.). Wiley Plus.
- Wikipedia. (2020). Acrilonitrile. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Acrilonitrile. Database PubChem., CID = 7855. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Elsevier b.V. (2020). Acrilonitrile. Scienceirect. Estratto da: ScienceDirect.com
- Korry Barnes. (2020). Cos'è l'acrilonitrile? - Usa e proprietà. Studio. Recuperato da: studio.com
- Pajonk, g.M., Manzalji, t. (1993). Sintesi di acrilonitrile da miscele di propilene e ossido nitrico su PBO2-Zro2 Catalizzatori Airgel. Catal Lett ventuno, 361-369. doi.org/10.1007/BF00769488
- « Caratteristiche di programmazione dinamica, esempio, vantaggi, svantaggi
- Cos'è un processo isotermico? (Esempi, esercizi) »

