Struttura dell'acetato di sodio, proprietà, sintesi, usi

- 2493
- 451
- Lino Lombardi
Lui Acetato di sodio È un sale di sodio di acido acetico la cui formula molecolare è C2H3O2N / a. È costituito da una polvere bianca delicata, presente essenzialmente in due forme: anidro e triidrato. Entrambi sono molto solubili in acqua, il solvente universale; Ma non così solubile in alcoli o acetone.
La forma Anhydra ha una densità, una fusione e un punto di ebollizione con valori più alti rispetto a quelli presentati dalla forma di triidrato di sodio acetato. Questo perché le molecole d'acqua interferiscono tra le interazioni ioni+ e ch3COO-.
 Aspetto acetato di sodio
Aspetto acetato di sodio L'acetato di sodio è stabile, soprattutto se è immagazzinato tra 2 e 8 ºC; Ma è suscettibile all'azione di forti agenti ossidanti e alogeni.
Può essere preparato dalla reazione del bicarbonato di sodio con acido acetico. Inoltre, con la reazione di acido acetico con idrossido di sodio. Entrambe le reazioni sono semplici a elaborate e a basso costo economico; Il primo può essere fatto a casa.
Questo sale è un piccolo composto tossico. Produce un'irritazione della pelle, solo dopo un contatto frequente e continuo. È poco irritante per gli occhi ma può irritare le vie aeree. Non ci sono informazioni su un effetto dannoso della tua ingestione.
Ha numerosi usi e applicazioni, evidenziando la sua funzione di smorzamento del pH, insieme all'acido acetico. L'ammortizzatore di acetato ha un PKA = 4,7; che conferisce un'elevata efficienza nella regolazione del pH in un ambiente acido con valori di pH tra 3 e 6.
A causa della sua bassa tossicità e delle sue proprietà, è stato ampiamente utilizzato per migliorare il gusto del cibo, nonché un agente che fornisce protezione contro la loro decomposizione a causa della loro azione contro i microbi.
[TOC]
Struttura dell'acetato di sodio
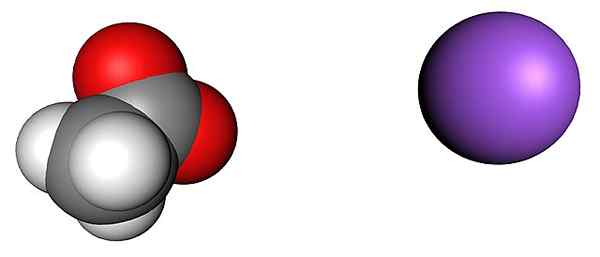 Acetato e ioni di sodio. Fonte: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Acetato e ioni di sodio. Fonte: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] L'immagine superiore mostra gli ioni che compongono i cristalli di acetato di sodio anidro (senza acqua). La sfera viola corrisponde alla nazione nata+, E lo ione molecolare alla sua sinistra è acetato, Cho3COO-, Con i suoi atomi di ossigeno rappresentati da sfere rosse.
Questi coetanei, secondo il chip ch3Path, sono in una proporzione 1: 1; Per ogni Cho3COO-, Deve esserci un nazione+ attratto dal suo carico negativo e viceversa. Pertanto, le attrazioni tra loro e le repulsioni tra carichi uguali, finiscono per stabilire modelli strutturali che definiscono un cristallo, la cui espressione minima è la cellula unitaria.
Questa cellula unitaria, come il vetro nel suo insieme, varia a seconda della disposizione degli ioni nello spazio; Non è sempre lo stesso, anche per lo stesso sistema cristallino. Ad esempio, l'acetato di sodio anidro può formare due polimorfi ortorrombici, uno dei quali è rappresentato di seguito:
 Cellula unitaria di acetato di sodio cristalli ortorombici. Fonte: Benjah-BMM27 [dominio pubblico]
Cellula unitaria di acetato di sodio cristalli ortorombici. Fonte: Benjah-BMM27 [dominio pubblico] Nota la disposizione degli ioni: quattro ioni CHO3COO- Allega un NA+ in modo tale da "disegnare" una piramide di base quadrata distorta. Ognuno di questi Cho3COO- a sua volta interagisci con un altro NA+ adiacente.
Cristalli idratati
L'acetato di sodio ha molta affinità per l'acqua; In effetti è delizioso, cioè mantiene l'umidità fino a quando non viene sciolta nello stesso. Maggiore è l'umidità, prima è "si scioglie". Questo perché è così3COO- Come na+ Possono idratarsi, circondarsi di molecole d'acqua che guidano i loro dipoli verso i loro carichi (NA+ OH2, Cap3COO- Hoh).
Può servirti: Silver Bromide (AGBR): struttura, proprietà e usiQuando questo sale viene preparato in laboratorio o a casa, è una tale affinità per l'acqua che anche a temperature normali è già ottenuta come idrata; il ch3Pata · 3h2O. I loro cristalli cessano di essere ortorrombici e diventano monoclinici, poiché ora incorporano tre molecole d'acqua per ogni coppia Cho3COO- e na+.
Proprietà
Nomi
-Acetato di sodio.
-Sodio etanoato (Iupac).
Massa molare
-Anidro: 82,03 g/mol.
-Triidratato: 136,03 g/mol.
Aspetto
Polvere bianca delicuescente.
Odore
All'aceto quando viene riscaldato alla decomposizione.
Densità
-Anhidro: 1, 528 g/cm3 a 20 ºC.
-Triidratato: 1,45 g/cm3 a 20 ºC.
Punto di fusione
-Anhidro: 324 ºC (615 ºF, 597 K).
-Trioidrato: 58 ºC (136 ºF, 331 K).
Punto di ebollizione
-Anhidro: 881,4 ºC (1.618,5 ºF, 1.154,5 k).
-Triidrato: 122 ºC (252 ºF, 395 K). Si decompone.
Solubilità
In acqua
-ANYDRO: 123,3 g/100 ml a 20 ° C.
-Triidratato: 46,4 g/100 ml a 20 ºC.
In metanolo
16 g/100 g a 15 ºC.
In etanolo
5,3 g/100 ml (triidrato).
In acetone
0,5 g/kg a 15 ° C.
Acidità
PKA: 24 (20 ºC).
Basicità
PKB: 9.25. Qui è evidente che l'acetato di sodio è un sale di base per dover avere PKB inferiore al suo PKA.
Indice di rifrazione (ηd)
1.464
Capacità calorica
-100,83 J/mol · K (anidro).
-229,9 J/mol · K (Trihydrado).
punto di accensione
Oltre 250 ° C.
Temperatura di auto -Identizione
600 ºC.
ph
8,9 (soluzione da 0,1 m a 25 ºC).
Stabilità
Stabile. Incompatibile con agenti ossidanti forti e alogeni. Umidità.
Reazioni
L'acetato di sodio può formare un estere reagendo con un alogenuro a noleggio; Ad esempio, Bromoetano:
Cap3Poron +Brch2Cap3 => Ch3Cooch2Cap3 + Nabr
L'acetato di sodio è decarbossila per formare metano (pirolisi) in presenza di NaOH:
Cap3Poon +NaOH => CH4 + N / a2Co3
La reazione è catalizzata dalle vendite di Cesio.
Sintesi
L'acetato di sodio può essere prodotto a basso costo in laboratorio reagendo il bicarbonato di sodio con acido acetico:
Nahco3 + Cap3COOH => CH3Path +H2Co3
Questa reazione è accompagnata dalla presenza nella soluzione di un'intensa bolla, a causa della decomposizione dell'acido carbonico in acqua e anidride carbonica.
H2Co3 => H2O +co2
Industrialmente, l'acetato di sodio è prodotto dalla reazione di acido acetico con idrossido di sodio.
Cap3COOH +NaOH => CH3Path +H2O
Applicazioni
Sacchi termici
L'acetato di sodio viene utilizzato per la produzione di sacchetti termici.
Inizialmente, i cristalli di sale vengono sciolti in un volume di acqua per la preparazione di una soluzione che diventa sovrasaturata.
Quindi la soluzione a una temperatura maggiore di 58 ºC viene riscaldata, che è il suo punto di fusione. La soluzione sovrasaturata a temperatura ambiente può raffreddare e non si osserva la formazione di cristalli; La soluzione è superiori a -Chirp.
Può servirti: tavola periodica, a cosa serveL'assenza di cristalli è spiegata che le molecole liquide sono troppo disordinate e non hanno una guida dovuta per raggiungere la temperatura di cristallizzazione. Il liquido è in uno stato metastabile, uno stato di squilibrio.
Dare. Nel caso di sacchi termici, viene premuto un attacco meccanico per mescolare il liquido e iniziare la formazione di cristalli e la solidificazione della soluzione di acetato di sodio triidratato.
Man mano che si verifica la cristallizzazione, la temperatura sta aumentando. I cristalli di acetato di sodio triidratato acquisiscono l'aspetto del ghiaccio, ma sono caldi, quindi si chiama "Ice caldo".
Industriali
-L'acetato di sodio viene utilizzato nell'industria tessile come mordente nel processo di colorazione dei tessuti
-Neutralizzare i rifiuti di acido solforico
-È utilizzato nell'elaborazione del cotone per l'elaborazione di pad di cotone, utilizzabile nella pulizia personale e per scopi medici
-È usato nel decapaggio in metallo, prima del suo cromo
-Collabora in modo che la vulcanizzazione del cloropene non si verifichi nel processo di produzione di gomma sintetica
-Interviene nella purificazione del glucosio
-È usato nelle pelli abbronzanti.
Uso medico
L'acetato di sodio fa parte dei composti utilizzati per fornire elettroliti somministrati ai pazienti per via endovenosa.
Viene utilizzato per correggere i livelli di sodio nei pazienti iponatemici, anche nella correzione dell'acidosi metabolica e dell'alcalinizzazione delle urine.
Soluzione di smorzamento del pH
È usato come regolatore di pH in molte reazioni enzimatiche che si verificano tra pH 3 e pH 6.
Il diverso pH della soluzione di tampone acetato è raggiunto dalla variazione della concentrazione di acido acetico e acetato di sodio.
Ad esempio, per ottenere un pH 4,5 la soluzione tampone ha una concentrazione di acido acetico di 3,8 g/L e una concentrazione di acetato di sodio anidro di 3,0 g/L.
La concentrazione della soluzione tampone acetata può essere aumentata, aumentando nella stessa proporzione i componenti della soluzione necessaria per ottenere il pH desiderato.
Acetato/Acetonitrile Shock Assorber è usato nell'elettroforesi capillare nella separazione della fotoberberina.
Laboratori di ricerca
-L'acetato di sodio è un debole agente nucleofilo che viene utilizzato nella polimerizzazione anionica del β-latino.
-È usato come reagente nella risonanza magnetica nucleare delle macromolecole biologiche.
-È usato nell'estrazione delle cellule delle cellule. Il sodio è un catione che interagisce con i carichi negativi di fosfati presenti nel DNA, che aiuta nella sua condensazione. In presenza di etanolo, il DNA forma un precipitato che può quindi essere separato nello strato acquoso.
Conservazione del cibo
-Aiuta a prevenire la crescita batterica, oltre a prevenire la generazione di acidità in eccesso che causa il deterioramento degli alimenti, mantenendo così un pH specifico.
-Il sodio presente in acetato migliora il gusto del cibo.
-L'acetato di sodio viene utilizzato nella preparazione di sottaceti vegetali: cetriolo, carota, cipolla, ecc. Inoltre, è usato nella conservazione della carne.
Può servirti: dimetilanilina: struttura, proprietà, sintesi, usiConservazione del cemento
Il calcestruzzo è danneggiato dall'azione dell'acqua che accorcia la sua durata. L'acetato di sodio funge da agente di sigillante in cemento che lo impermettisce in acqua, prolungando le sue caratteristiche iniziali.
Giovani esperimenti
Esperimento 1
Un semplice esperimento è la sintesi di acetato di sodio attraverso la reazione di bicarbonato di sodio con aceto (acido acetico al 5%).
30 ml di aceto sono posti in un becher e vengono aggiunti circa 3,5 g di bicarbonato.
Nella reazione si forma le forme di sodio e acido carbonico. L'acido viene suddiviso in anidride carbonica e acqua. La generazione di anidride carbonica produrrà una bolla intensa all'interno della soluzione.
Per raccogliere acetato di sodio, viene causata l'evaporazione dell'acqua, riscaldando la soluzione.
Esperimento 2
Un altro semplice esperimento è la formazione di acetato di treidrato di sodio.
Per fare ciò, circa 20 g di triidrato di acetato di sodio e collocato in un becher, quindi aggiungendo 10 ml di acqua, quindi aggiungendo 10 ml di acqua. La soluzione è riscaldata a una temperatura superiore a 58 ºC.
L'acetato di sodio è completamente sciolto per garantire che la soluzione sia sovrasaturata. In precedenza, una capsula Pietri è posizionata su una superficie fredda.
Il contenuto del becher con acetato triidrato nella capsula di Pietri viene lentamente versato. La temperatura del liquido nella capsula inizia a scendere, anche sotto il punto di fusione, senza osservare la cristallizzazione o la solidificazione del triidrato acetato di sodio.
Di solito per produrre la cristallizzazione dell'acetato di sodio triidratato, viene aggiunta una piccola quantità di sale per fungere da nucleo di cristallizzazione. Altre volte c'è un piccolo disturbo della soluzione, per iniziare la cristallizzazione dell'acetato di sodio.
I cristalli di acetato di sodio triidratato sembrano il ghiaccio, ma se vengono toccati si noterà che sono relativamente caldi. Per questo motivo, il sale si chiama "Ice caldo".
Tossicità
L'acetato di sodio è un composto molto piccolo. Né è classificato come sensibilizzatore per la pelle e le vie aeree.
Inoltre, l'acetato di sodio non è classificato come agente mutageno in germe, cancerogeno o cellule tossiche per la riproduzione.
In breve, è poco irritante per gli occhi. Le vie aeree possono essere irritate dopo la loro inalazione. Il contatto frequente e costante con la pelle può causare irritazione.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Worldfchemicals. (16 gennaio 2017). Come preparare l'acetato di sodio a casa? Recuperato da: medio.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Acetato di sodio. Database PubChem. CID = 517045. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- S. Cameron, k. M. Mannan e m. O. Rahman. (1976). La struttura cristallina del triidrato di acetato di sodio. Cryst Act. B32, 87.
- Wikipedia. (2019). Acetato di sodio. Recuperato da: in.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (24 gennaio 2019). Prepara il ghiaccio caldo dall'aceto e il bicarbonato di sodio. Recuperato da: Thoughtco.com
- Libro chimico. (2017). Acetato di sodio. Recuperato da: chimico.com
- Wasserman Robin. (2019). Usi dell'acetato di sodio. Recuperato da: Livestrong.com
- Banco di droga. (2019). Acetato di sodio. Recuperato da: Drugbank.AC

