Struttura dell'acetato di potassio, proprietà, usi, ottenendo
- 5033
- 1178
- Dott. Rodolfo Gatti
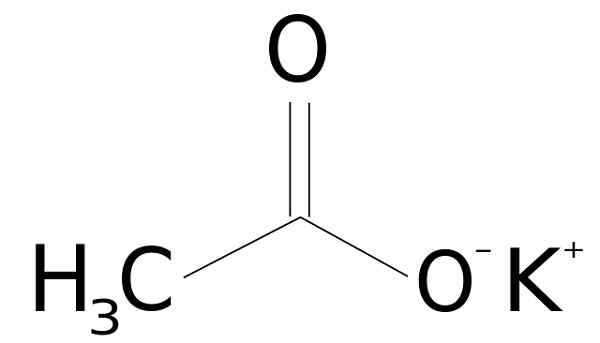
Lui acetato di potassio È un composto organico formato da un potassio ionico k+ e un acetato ionico Cho3COO-. La sua formula chimica è Cho3Cuocere o kch3COO, o anche C2H3Ko2. È un solido cristallino incolore o bianco, molto solubile in acqua.
Viene utilizzato per regolare l'acidità di alcuni alimenti trasformati industrialmente. A causa della sua grande affinità con l'acqua, viene utilizzato nei laboratori o in alcuni processi per assorbire l'acqua da altri composti, come per disidrare l'alcol.
 Acetato di potassio KCH3CO serve a regolare l'acidità di alcuni alimenti trasformati. Autore: Ritae. Fonte: Pixabay.
Acetato di potassio KCH3CO serve a regolare l'acidità di alcuni alimenti trasformati. Autore: Ritae. Fonte: Pixabay. L'acetato di potassio partecipa ad alcune reazioni chimiche come il loro acceleratore e nella sintesi di composti organici. Consente inoltre l'aumento della formazione di anticorpi (sostanze naturali che combattono le infezioni) nei metodi industriali per produrre loro.
Le sue proprietà a temperature molto basse lo rendono un buon candidato da utilizzare nelle miscele per sciogliere il ghiaccio su strade di cemento in climi molto freddi. Secondo fonti consultate, viene anche utilizzato nelle apparecchiature per combattere gli incendi e gli assemblaggi per osservare le cellule nei microscopi.
[TOC]
Struttura
L'acetato di potassio è formato da un catione di potassio k+ e un anione acetato Cho3COO-. Quest'ultimo è la base coniugata dell'acido acetico CH3COOH. L'acetato Cho3COO- è costituito da un metil -ch3 insieme a un carbossilato -coo-.
L'unione tra i due ioni è elettrostatica o ionica, cioè l'unione tra uno ione positivo e negativo.
 Struttura acetata di potassio CH3Cucinare. Sssilver [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura acetata di potassio CH3Cucinare. Sssilver [dominio pubblico]. Fonte: Wikimedia Commons. Nomenclatura
- Acetato di potassio
- Potassio etanoato
- Sale di potassio acido acetico
- ACOK
- Koac
Proprietà
Stato fisico
Bianco incolore solido o cristallino.
Peso molecolare
98,14 g/mol
Punto di fusione
292 ºC
Densità
1,6 g/cm3
Solubilità
Molto solubile in acqua: 256 g/100 ml a 20 ° C.
ph
Una soluzione acquosa al 5% di acetato di potassio ha un pH di 7,5-9,0.
Altre proprietà
A volte ha un odore debole di aceto. In una soluzione al 10% non attacca l'alluminio a temperatura ambiente ma a 60-70 ° C il metallo si oscura e soffre di morsi.
A concentrazioni del 20% o più, l'attacco superficiale sull'alluminio si verifica a qualsiasi temperatura.
Può servirti: HydraceL'acetato di potassio (ACOK) è altamente solubile in acqua. Ha un idrato: il KCH3COO.1,5h2Oppure, che è il solido che si ottiene cristallizzandolo dalle soluzioni acquose ACOK.
Comportamento durante il riscaldamento
Se l'acetato di potassio (ACOK) (KCH (KCH) viene sottoposto al riscaldamento (KCH3COO.1,5h2O) Al raggiungimento di 40 ° C, l'acqua di idratazione inizia a perdere.
KCH3COO.1,5h2O → KCH3COO + 1,5h2O ↑
Se l'acetato di potassio anidro viene riscaldato (senza acqua: KCH3COO), quando si raggiunge i 340 ° C, inizia a decomporsi formando carbonato di potassio k2Co3 Secondo la seguente reazione:
2 kch3COO + 4 o2 → k2Co3 + 3 h2O + 3 CO2↑
Ottenimento
Può essere preparato dall'azione dell'idrossido di potassio KOH su diversi composti, come l'acido CHO3COOH, anidride acetica (CH3CO)2O e Ammonio Acetate Cho3Poonh4.
KOH +CH3COOH → CH3Cuocere + h2O
Può anche essere ottenuto reagendo il carbonato di potassio k2Co3 O Khco Potassio Bicarbonato3 Con acido acetico CH3COOH.
Khco3 + Cap3COOH → CH3Cuocere +h2O + co2↑
L'acetato di potassio può essere cristallizzato da una soluzione acquosa per ottenerlo ad alta purezza.
Applicazioni
In diverse applicazioni
L'acetato di potassio viene utilizzato nell'industria alimentare trasformata come regolatore di acidità. È usato come essiccante nei metodi chimici per misurare la permeabilità al vapore acqueo di alcuni tessuti.
Serve come agente disidratante dell'etanolo nella produzione di questo alcool basato su lignocellulosa, un materiale derivato dal legno.
Viene utilizzato per produrre antibiotici ed è ampiamente utilizzato nell'attrezzatura da combattimento antincendio.
Nell'industria dei polimeri
Viene utilizzato per riciclare i poliuretani perché serve a catalizzare o accelerare le reazioni di idrolisi e glicolisi di tali polimeri per diventare alcoli e ammine.
Viene anche utilizzato nella produzione di resine di silicone organico.
In laboratori di ricerca scientifica e medica
L'acetato di potassio ad alta purezza viene utilizzato nei laboratori come reagente di chimica analitica. Anche per condurre ricerche mediche.
Può servirti: neon: storia, proprietà, struttura, rischi, usiNei laboratori istopatologici serve a garantire un mezzo di pH neutro negli assiemi di microscopi.
 Acetato di potassio ha vari usi nei laboratori di ricerca chimica e medica. Autore: Michal Jarmoluk. Fonte: Pixabay.
Acetato di potassio ha vari usi nei laboratori di ricerca chimica e medica. Autore: Michal Jarmoluk. Fonte: Pixabay. È usato per la sintesi di composti organici eterociclici, che sono composti con cicli di dimensioni diverse.
Alcuni microelettrodi che servono a studiare le proprietà elettriche delle cellule, sono riempiti con una soluzione di acetato di potassio concentrata.
Nella produzione industriale di anticorpi
L'acetato di potassio serve la produzione su larga scala di anticorpi monoclonali (che sono quelli che provengono dalla stessa cellula staminale) nelle colture cellulari. Permette di stimolare la sintesi o la formazione di anticorpi.
Gli anticorpi sono sostanze prodotte da alcune cellule del sangue per combattere le infezioni da virus o batteri.
 Immagine anticorpale artistica. Acetato di sodio KCH3CO serve nella produzione di anticorpi in grandi quantità. Blitzkrieg1982 [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.Sebbene l'acetato di potassio (ACOK) inibri o ritardi la crescita cellulare e diminuisca la densità cellulare, aumenta la produttività degli anticorpi per ciascuna cellula.
Immagine anticorpale artistica. Acetato di sodio KCH3CO serve nella produzione di anticorpi in grandi quantità. Blitzkrieg1982 [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.Sebbene l'acetato di potassio (ACOK) inibri o ritardi la crescita cellulare e diminuisca la densità cellulare, aumenta la produttività degli anticorpi per ciascuna cellula.
 Attacco di anticorpi che attira alcuni batteri. SA1590 [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Attacco di anticorpi che attira alcuni batteri. SA1590 [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. In miscele antihielo
L'acetato di potassio è stato usato nelle miscele antihielo (traduzione inglese Anti-occidentale) per usarli per sciogliere i marciapiedi stradali e cemento e quindi consentire l'uso sicuro di questi.
 Durante la stazione invernale le strade sono piene di neve e ghiaccio. L'acetato di potassio può essere utile in questi casi. Autore: s. Hermann e F. Richter. Fonte: Pixabay.
Durante la stazione invernale le strade sono piene di neve e ghiaccio. L'acetato di potassio può essere utile in questi casi. Autore: s. Hermann e F. Richter. Fonte: Pixabay. La selezione dell'acetato di potassio (ACOK) per questa applicazione è dovuta a una soluzione acquosa del 50% in base al peso ACOK è un eutctico e ha un punto di fusione di -62 ° C. Ciò significa che anche a temperature fino a -62 ° C la soluzione rimane fusa.
Un euttico è una miscela omogenea di componenti che ha il minimo punto di fusione di tutte le possibili miscele, compresi i componenti puri.
Come funziona come un antihielo
Acetato di potassio (ACOK) ha un'ottima capacità di sciogliere il ghiaccio.
A -5 ° C è in grado di sciogliere 11,5 kg di ghiaccio per ogni kg di ACOK. Questa proprietà diminuisce diminuendo la temperatura, ma anche a -50 ° C ha la capacità di sciogliere 1,3 kg di ghiaccio per ogni kg di ACOH.
Può servirti: solidi cristallini: struttura, proprietà, tipi, esempiA -5 ° C Questa capacità è paragonabile a quella del cloruro di sodio o del sale da tavola (NaCl), mentre da -30 ° C lontano.
 L'acetato di potassio ti consente di sciogliere il ghiaccio su strade congelate. Autore: Markus SCH. Fonte: Pixabay.
L'acetato di potassio ti consente di sciogliere il ghiaccio su strade congelate. Autore: Markus SCH. Fonte: Pixabay. Tuttavia, nei test eseguiti con l'ACOK insieme ad altri composti, è stato osservato un certo grado di corrosione delle superfici del cemento, quindi è stato proposto di aggiungere anticorrosivi alle miscele antihielo.
D'altra parte, la miscela di acetato di potassio (CH3Cuocere) con la formazione di potassio (HCOOK) è un eccellente antihielo e non richiede anticorrosivo.
Riferimenti
- Baker, f.J. et al. (1976). Procedure di colorazione. Montanti acquosi. In Introduzione alla tecnologia di laboratorio medico (quinta edizione). Recuperato da ScienceDirect.com.
- Hassan, a.A. et al. (2018). Inzoles: sintesi e eterociclizzazione. In progressi nella chimica eterociclica. Recuperato da ScienceDirect.com.
- O.S. Biblioteca nazionale di medicina. (2019). Acetato di potassio. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Das, a. e alagirusamy, r. (2010). Trasmissione di umidità. Metodo della tazza invertita essiccante. Nella scienza nel comfort dell'abbigliamento. Recuperato da ScienceDirect.com.
- Vargel, c. (2004). Acidi carbossilici e loro derivati. Acetate. In corrosione dell'alluminio. Recuperato da ScienceDirect.com.
- Cuevas, j. (2014). Tecniche di registrazione elettrofisiologica. Tecniche di registrazione intracellulare. Nella modulazione di riferimento nelle scienze biomediche. Recuperato da ScienceDirect.com.
- Fink, j.K. (2018). Poli (uretano) s. Raccolta differenziata. Solvolisi. In polimeri reattivi: fondamentali e applicazioni (terza edizione). Recuperato da ScienceDirect.com.
- Fong, w. et al. (1997). Ottimizzazione della produzione di anticorpi monoclonali: effetti combinati di acetato di potassio e perfusione in un bioreattore a vasca agitato. Citotechnologia 24: 47-54. Link recuperato.Springer.com.
- Danilov, v.P. et al. (2012). Reagenti antidimici a bassa temperatura in sistemi di sale acquoso contenenti acetati e formiati. Fondamenti teorici dell'ingegneria chimica, 2012, vol 46, no. 5, pp. 528-535. Link recuperato.Springer.com.
- Falsev, a.A.et al. (2012). Ricerca e sviluppo del metodo per l'acetato di potassio di alta purezza. Journal of Applied Chemistry, 2012, Vol. 85, n.12, pp. 1807-1813. Link recuperato.Springer.com.
- « Unità di shock magnetico, formule, calcolo, esempi
- Dispositivi di input caratteristici, quali sono l'uso, tipi, esempi »

