Yoduro ma caratteristiche, struttura, funzioni
- 3305
- 794
- Ruth Cattaneo
IL Yoduro perossidasi o la perossidasi tiroidea (TPO) è un'emo-glicoproteina appartenente alla famiglia delle perossidasi di mammiferi (come la mieloperossidasi, la lattoperossidasi e altri) che partecipa alla via della sintesi dell'ormone tiroideo.
La sua funzione principale è quella della "ioodinazione" dei rifiuti di tirosina nella tioglobulina e della formazione del 3-3'-5-triiodotironina (T3) e della tiroxina (T4) attraverso una reazione di "accoppiamento" intramolecolare.
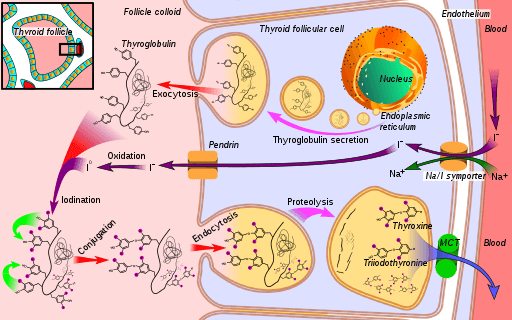
 Schema della via biosintetica dell'ormone tiroideo, in cui la perossidasi di ioduro (nell'ossidazione della ioduro a iodio) (fonte: Mikael Häggström [CC0] tramite Wikimedia Commons)
Schema della via biosintetica dell'ormone tiroideo, in cui la perossidasi di ioduro (nell'ossidazione della ioduro a iodio) (fonte: Mikael Häggström [CC0] tramite Wikimedia Commons) La triiodronina e la tiroxina sono due ormoni prodotti dalla ghiandola tiroidea che hanno funzioni essenziali nello sviluppo, differenziazione e metabolismo dei mammiferi. Il suo meccanismo d'azione dipende dall'interazione dei suoi recettori nucleari con sequenze geniche specifiche dei suoi geni bianchi.
L'esistenza dell'enzima di Yoduro perossidasi è stata confermata negli anni '60 da autori diversi e attualmente sono stati fatti notevoli progressi riguardo alla determinazione della sua struttura, alle sue funzioni e alle caratteristiche del gene che lo codifica in diversi organismi.
In gran parte della letteratura legata a questo enzima, questo è noto come "autoantigene" microsomiale ed è correlato ad alcune malattie autoimmuni tiroidee.
Grazie alle sue caratteristiche immunogeniche, questo enzima è una molecola bianca o bersaglio.
[TOC]
Caratteristiche
Lo ioduro di perossidasi è codificato da un gene situato sul cromosoma 2 dell'uomo, che misura più di 150 kpb ed è composto da 17 esoni e 16 introni.
Questa proteina transmembraale, con un singolo segmento immerso nella membrana, è strettamente correlata alla mieloperossidasi, con la quale condivide oltre il 40% della somiglianza della sequenza di aminoacidi.
Può servirti: acilgliceridi: caratteristiche, struttura, tipi, funzioniLa sua sintesi si verifica nei poliribosomi (insieme di ribosomi che sono responsabili della traduzione della stessa proteina) e quindi viene inserito nella membrana del reticolo endoplasmatico, dove passa attraverso un processo di glicosilazione.
Una volta sintetizzato e glicosilato, lo ioduro di perossidasi viene trasportato nel polo apicale della trazione (cellule tiroidee o cellule tiroidei), dove è in grado di esporre il suo centro catalitico verso il lumen follicolare della tiroide.
Regolazione dell'espressione
L'espressione del gene codificante della perossidasi tiroidea o ioduro è controllata da specifici fattori di trascrizione tiroideo come TTF-1, TTF-2 e PAX-8.
Gli elementi genetici che consentono di aumentare o migliorare l'espressione di questo gene nell'uomo sono stati descritti nelle regioni che fiancheggiano la fine 5 'della stessa, di solito tra le prime 140 coppie di basi di questa regione "Flanqueante".
Ci sono anche elementi che reprimono o riducono l'espressione di questa proteina, ma a differenza dei "potenziatori", questi sono stati descritti a valle della sequenza genica.
Gran parte della regolazione dell'espressione genetica della perossidasi di ioduro si verifica in modo specifico del tessuto, e ciò dipende dall'azione degli elementi dell'Unione del DNA che agiscono Cis, come i fattori di trascrizione TTF-1 e altri.
Struttura
Questa proteina con attività enzimatica ha circa 933 rifiuti di aminoacidi e un'estremità c-terminale extracellulare di 197 aminoacidi che provengono dall'espressione di altri moduli genici che codificano per altre glicoproteine.
Il suo peso molecolare è di circa 110 kDa e fa parte del gruppo proteico transmembrano glicosilato di tipo 1, poiché ha un segmento transmembrano glicosilato e un gruppo HEMO nel suo luogo attivo attivo.
Può servirti: ghiandole: tipi, funzione, infiammazione e malattieLa struttura di questa proteina ha, almeno, un ponte disolfuro nella regione extracellulare che forma un caratteristico anello chiuso che è esposto sulla superficie dei tirociti.
Funzioni
La principale funzione fisiologica dello ioduro di perossidasi è correlata alla sua partecipazione alla sintesi dell'ormone tiroideo, in cui catalizza l '"iodazione" dello spreco di tirosina di monoyodotirosina (MIT) e diorosina (DIOROSINE) Residui in tyoglobulin.
Qual è la sintesi dell'ormone tiroideo?
Per comprendere la funzione dell'enzima perossidasi tiroide è necessario considerare le fasi della sintesi ormonale in cui partecipa:
1 Si-Sitness con il trasporto di ioduro alla tiroide e continua con
2-Generazione di un agente ossidante come il perossido di idrogeno (H2O2)
3-posteriormente una proteina ricevente è sintetizzata, la tioglobulina
4-yoduro è ossidato a uno stato di Valencia più antica e dopo
5-yoduro è unito ai rifiuti di tirosina presenti nella tioglobulina
6 pollici di tioglobulina, iodothye (un tipo di ormoni tiroidei) si formano a causa dell'accoppiamento dei rifiuti riodotici
7-La tyoglobulina viene immagazzinata e sputata, quindi
8-Iodirosinas iodirosinas viene rimosso e, infine,
La 9-tiroxina viene rilasciata e triiodotiron verso il sangue; Questi ormoni esercitano i loro effetti per interazione con i loro recettori specifici, che si trovano nella membrana nucleare e sono in grado di interagire con sequenze di DNA bianco, funzionando come fattori di trascrizione.
Come potrebbe essere distaccato dalla conoscenza delle funzioni dei due ormoni la cui sintesi partecipa (T3 e T4), lo ioduro di perossidasi ha importanti implicazioni a livello fisiologico.
La mancanza di entrambi gli ormoni durante lo sviluppo umano produce difetti nella crescita e nel ritardo mentale, nonché squilibri metabolici nella vita adulta.
Può servirti: oloenzima: caratteristiche, funzioni ed esempiMalattie correlate
Lo ioduro perossidasi è uno dei principali autoantigeni tiroidei nell'uomo ed è correlato alla citotossicità mediata dal sistema del complemento. La sua funzione di autoantigene si distingue nei pazienti con malattie autoimmuni tiroidee.
La malattia di Gota, ad esempio, è dovuta a una carenza di contenuto di iodio durante la sintesi ormonale nella tiroide, che è stata collegata a un prodotto di carenza di iodinazione tiroglobulina di alcuni difetti in alcuni difetti nella perossidasi perossidasi.
Alcuni carcinomi sono caratterizzati da funzioni alterate dello ioduro di perossidasi, ovvero i livelli di attività di questo enzima sono significativamente inferiori rispetto ai pazienti non cancerosi.
Tuttavia, gli studi hanno confermato che si tratta di una caratteristica estremamente variabile, che dipende non solo dal paziente, ma dal tipo di cancro e dalle regioni interessate.
Riferimenti
- Degroot, l. J., & Niepomniszcze, h. (1977). Biosintesi dell'ormone tiroideo: aspetti di base e clinici. Progressi in endocrinologia e metabolismo, 26(6), 665-718.
- Fragu, p., & Nataf, b. M. (1976). Attività della perossidasi tiroidea umana in disturbi tiroidei benigni e maligni. La società endocrina, Quattro cinque(5), 1089-1096.
- Kimura, s., & Ikeda-saito, m. (1988). Myeloperossidae umana e perossidasi tiroidea, due enzimi con funzioni fisiologiche separate e distinte, sono membri correlati evolutivi della stessa famiglia genica genica. Proteine: struttura, funzione e bioinformatica, 3, 113-120.
- Nagasaka, a., Hidaka, h., & Ishizuki, e. (1975). Studi sulla perossidasi di ioduro umano: la sua attività in vari disturbi della tiroide. Atto chimico clinico, 62, 1-4.
- Ruf, J., & Carayon, P. (2006). Aspetti strutturali e funzionali della perossidasi tiroidea. Archivi di biochimica e biofisica, 445, 269-277.
- Ruf, J., Toubert, m., CZarnocka, b., Durand-Gorde, m., Ferrand, m., & Carayon, P. (2015). Relazione tra struttura immunologica e proprietà biochimiche della perossidasi tiroidea umana. Recensioni endocrine, 125(3), 1211-1218.
- Taurog, a. (1999). Evoluzione molecolare della perossidasi tiroidea. Biochimie, 81, 557-562.
- Zhang, j., & Lazar, M. A. (2000). Il meccanismo d'azione degli ormoni tiroidei. Annu. Rev. Fisiolo., 62(1), 439-466.
- « Operazione enzimatica ed esempi
- Rivoluzione boliviana del 1952 cause, caratteristiche, conseguenze »

