Struttura di ioduro di potassio (KI), proprietà, ottenimento, usi, rischi

- 3973
- 573
- Benedetta Rinaldi
Lui ioduro di potassio È un composto inorganico formato da uno ione di potassio (K+) e uno ione ioduro (i-). La sua formula chimica è Ki. È un solido cristallino bianco, di natura ionica ed è molto solubile in acqua.
Il KI consente diverse reazioni chimiche e analisi e viene utilizzato per misurare la quantità di ozono nell'atmosfera. Viene anche utilizzato nelle apparecchiature di analisi a infrarossi (IR).
 Ioduro di potassio solido ki. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons.
Ioduro di potassio solido ki. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons. Lo ioduro di potassio viene aggiunto al sale da tavola comune per prevenire una carenza di iodio nelle persone, poiché ciò può costituire un grave problema di salute.
È usato come espettorante perché aiuta che il muco possa fluire facilmente dai canali respiratori all'esterno. Serve anche a trattare alcune infezioni da funghi ed è usato in alcuni cosmetici.
È usato dai medici veterinari per curare animali di problemi simili a quelli dell'uomo, come la tosse e le infezioni della pelle. Viene persino aggiunto in quantità molto piccole agli animali per gli animali.
[TOC]
Struttura
Lo ioduro di potassio è un composto ionico formato dal catione di potassio k+ E lo yoduro i anione-, Pertanto, tra loro il collegamento è ionico. Lo stato di ossidazione del potassio è +1 e Valencia del iodio è -1.
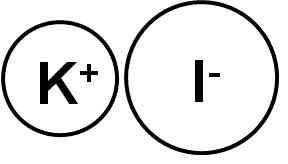 Lo ioduro di potassio è un composto ionico. Autore: Marilú Stea.
Lo ioduro di potassio è un composto ionico. Autore: Marilú Stea. I cristalli di ioduro di potassio ki sono cubi.
 Struttura di uno ioduro di potassio ki. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura di uno ioduro di potassio ki. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. Nomenclatura
- Ioduro di potassio
- Ioduro di potassio
Proprietà
Stato fisico
Solido bianco cristallino. Cristalli cubici.
Peso molecolare
166.003 g/mol
Punto di fusione
681 ºC
Punto di ebollizione
1323 ºC
Densità
3,13 g/cm3
Solubilità
Molto solubile in acqua: 149 g/100 g di acqua a 25 ° C. Leggermente solubile in etanolo ed etere.
Può servirti: neon: storia, proprietà, struttura, rischi, usiph
Le sue soluzioni acquose sono neutre o alcaline, con pH tra 7 e 9.
Proprietà chimiche
Leggermente igroscopico nell'aria umida.
È stabile in aria secca. La luce e l'umidità accelerano la sua decomposizione e le sue variazioni di colore in giallo a causa del rilascio di piccole quantità di iodio (i2) e Yodatos (io3-).
Anche le soluzioni acquose di ki diventano gialle nel tempo, tuttavia, con un po 'di alcali questo può essere evitato.
Queste soluzioni si dissolvono in iodio (i2) Dare ki3:
Yo- + Yo2 → i3-
Altre proprietà
Ha un sapore fortemente amaro e salino. Non è infiammabile.
Ottenimento
Lo ioduro di potassio può essere ottenuto riscaldando iodio (i2) In una soluzione concentrata di idrossido di potassio (KOH):
3 i2 + 6 koh → 5 ki + kio3 + H2O
La soluzione di yodio e ioduro risultante viene riscaldata per eliminare l'acqua, viene ridotta alla secchezza, il carbone viene aggiunto e riscaldato ad alta temperatura. Il carbone prende l'ossigeno dall'iodato e ossida l'anidride carbonica riducendo così lo ioduro allo ioduro:
2 kio3 + C → 2 ki + 3 co2
Lo ioduro di potassio ottenuto può essere ricryted per purificarlo. Cioè, è riscoperto in acqua e induce di nuovo a cristallizzazione.
Applicazioni
Nel trattamento dell'ipertiroidismo
Lo ioduro di potassio funge da trattamento aggiuntivo insieme ad altri agenti antitiroidei per trattare l'ipertiroidismo.
L'ipertiroidismo è una malattia che fa sì che la ghiandola tiroidea produca troppa ormone tiroide.
 Donna con tiroide infiammata. Può essere trattato con ioduro di potassio ki. https: // www.Myupchar.com/in [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Donna con tiroide infiammata. Può essere trattato con ioduro di potassio ki. https: // www.Myupchar.com/in [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Nei pazienti con ipertiroidismo, il KI diminuisce rapidamente i sintomi perché inibisce il rilascio dell'ormone tiroideo.
I suoi effetti tiroidei sono: ridotto la quantità di vasi sanguigni della ghiandola, riaffermazione dei loro tessuti e ridotto la dimensione delle loro cellule.
Per questo motivo si applica come trattamento preoperatorio per indurre l'involuzione o la diminuzione delle dimensioni della tiroide prima della tiroidectomia (rimozione della tiroide) perché questa operazione è facilitata.
Può servirti: sodio: storia, struttura, proprietà, rischi e usiIn altre applicazioni mediche
Lo ioduro di potassio ha proprietà espettoranti all'aumentare della secrezione di fluidi respiratori, con conseguente riduzione della viscosità del muco.
 Lo ioduro di potassio può fungere da espettorante nel trattamento della tosse. Autore: анастаball геп. Fonte: Pixabay.
Lo ioduro di potassio può fungere da espettorante nel trattamento della tosse. Autore: анастаball геп. Fonte: Pixabay. Serve per il trattamento del nodoso eritema, che è un'infiammazione dolorosa nelle gambe in cui si formano noduli arrossati e aumento della temperatura.
È un agente antihongos. Permette di trattare la sporotrosi che è un'infezione cutanea causata da un fungo. Questa malattia accade a persone che lavorano con piante e terreni, come agricoltori e giardinieri.
Viene anche usato nel trattamento della carenza di iodio o per evitarlo e quindi aggiungere al sale da tavola o al sale commestibile (NaCl di cloruro di sodio) come fonte di iodio e talvolta in acqua da bere.
In applicazioni veterinarie
Lo ioduro di potassio viene somministrato agli animali come antitustive, per aumentare e liquefare i fluidi del tratto respiratorio, per la tosse cronica bronchiale, nonché in caso di reumatismi e come anti -infiammatorio.
Serve anche per la micosi (infezioni fungine) degli animali, per ridurre il prurito e per l'avvelenamento da piombo cronico o mercurio.
Nella protezione della ghiandola tiroidea nelle emergenze radioattive
Lo ioduro di potassio ha proprietà protettive tiroidee nel caso in cui la persona sia stata esposta alle radiazioni nucleari.
Il KI inonda la tiroide con iodio non radioattivo bloccando così la presa di molecole radioattive e l'assorbimento di iodio radioattivo, proteggendo la ghiandola tiroidea dal cancro che può causare radiazioni.
Nelle misure di ozono nell'atmosfera
Gas di ozono (o3) Può essere misurato nell'atmosfera usando cellule elettrolitiche chiamate ozonosandas, che vengono trasportate da palloncini radiofonomici.
Può servirti: benzoto benzoatoQueste celle elettrolitiche contengono una soluzione di ioduro di potassio Ki. Le celle sono inizialmente in equilibrio chimico ed elettrico.
Quando un campione d'aria con ozono (o3) Penetra in una delle cellule che l'equilibrio è rotto perché si verifica la seguente reazione:
2 ki + o3 + H2O → i2 + O2 + 2 koh
Questa reazione produce una corrente elettrica che scorre tra le celle.
La quantità di corrente elettrica prodotta viene continuamente trasmessa dalle onde radio a una stazione a terra. In questo modo si ottiene il profilo dell'ozono che viene da terra all'altezza della palla.
 Balloon Take -off con radiosonda con ki per misurare l'ozono. Hannes Grobe 19:27, 20 giugno 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Germania [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/2.5)]. Fonte: Wikimedia Commons.
Balloon Take -off con radiosonda con ki per misurare l'ozono. Hannes Grobe 19:27, 20 giugno 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Germania [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/2.5)]. Fonte: Wikimedia Commons. In diversi usi
Lo ioduro di potassio consente anche:
- L'eliminazione di radicali liberi come l'idrossile radicale OH.
- La produzione di emulsioni fotografiche, per precipitare l'argento.
- Migliora l'alimentazione degli animali quando aggiunto in microconti.
- Deodorize Fertilizer del bestiame.
- Trasmettere la luce dello spettro a infrarossi nell'apparecchiatura di analisi IR.
- Eseguire alcune reazioni chimiche e analisi nei laboratori chimici.
- Usalo in prodotti per l'igiene personale.
- Eseguire analisi di inquinamento ambientale.
Rischi
Alcune persone sensibili allo ioduro.
Anche le persone con tubercolosi o bronchite acuta dovrebbero fare attenzione.
Il ki può causare ammorbidimento delle ghiandole salivari, può bruciare la bocca o la gola, un insolito aumento della salivazione, del dolore dei denti e dell'infiammazione delle gengive e del sapore metallico, tra gli altri sintomi.
Puoi anche irritare gli occhi e aprire ferite sulla pelle.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Ioduro di potassio. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Quarta edizione. John Wiley & Sons.
- Dean, J.A. (editore). (1973). Manuale di chimica di Lange. EDIZIONE ELEMENTH. McGraw-Hill Book Company.
- Valkovic, v. (2019). Decontaminazione dopo esposizione alle radiazioni. Parti del corpo più sensibili. In radioattività nell'ambiente (seconda edizione). Recuperato da ScienceDirect.com.
- Fabbro.G.J. (2015). Chimica delle osservazioni atmosfera per chimica (in situ). In Encyclopedia of Atmospher Sciences (Second Edition). Recuperato da ScienceDirect.com.
- Muralikrishna, i.V. e Manickam, V. (2017). Metodi analitici per il monitoraggio dell'inquinamento ambientale. Nella gestione ambientale. Recuperato da ScienceDirect.com.
- Wallace, J.M. e hobbs, p.V. (2006). Chimica atmosferica 1. In Atmospher Science (Second Edition). Recuperato da ScienceDirect.com.
- « Cambiamenti dei tipi di stato e le loro caratteristiche (con esempi)
- Concetto di decantazione, esempi e tipi »

