Ossidi non metallici

- 3872
- 740
- Dante Morelli
 L'anidride carbonica è un gas serra ed è anche un ossido non metallico
L'anidride carbonica è un gas serra ed è anche un ossido non metallico Quali sono gli ossidi non metallici?
IL Ossidi non metallici Sono composti binari formati tra uno stato non metallo con stato di ossidazione positivo e ossigeno con stato di ossidazione -2. Chiamati anche anidridi e ossidi acidi, questi composti tendono a formare soluzioni acide dissolvendoli in acqua e tendono anche a reagire con gli ossidi di base per formare sali ossisali.
Gli ossidi non metallici sono molto comuni in natura. In effetti, sono ovunque. L'acqua, il liquido vitale che copre i due terzi della superficie terrestre, è un ossido non metallico. Così sono l'anidride carbonica che espiriamo durante la nostra respirazione e gli ossidi di zolfo che contaminano l'aria e che causano pioggia acida.
Essendo formati da non metallici e ossigeno (che è anche non metal), i collegamenti che uniscono i loro atomi sono legami covalenti, nella maggior parte dei casi polari. Per questo motivo, la stragrande maggioranza di ossidi non metallici o anidridi ha punti di ebollizione considerevolmente bassi e molti di essi sono gas a temperatura ambiente.
Proprietà di ossidi non metallici
- Non hanno lucentezza o lucentezza metallica.
- Possono avere colori diversi.
- I loro atomi sono uniti per mezzo di legami covalenti anziché collegamenti ionici.
- Sono formati dall'ossigeno e da un non metal.
- Rispetto agli ossidi metallici, di solito hanno bassi punti di fusione e ebollizione, anche se molto diversi.
- La maggior parte sono gas, ma si trova anche in stato solido (come n2O3) o liquido a temperatura ambiente.
- Gli ossidi solidi non metallici sono generalmente fragili e possono avere una durezza diversa.
- Sono cattivi conduttori di calore ed elettricità.
- Quando li dissolvono in acqua, reagiscono per formare acidi oxacidi.
- Alcuni dei suoi acidi oxacidi sono acidi forti che tendono a formare anioni o ossiani in soluzione acquosa.
- Reagiscono con ossidi di base per formare sali ossisali.
Tipi di ossidi non metallici
Non esiste una classificazione formale o universalmente accettata di ossidi non metallici. Tuttavia, questi possono essere raggruppati in base alle loro proprietà di base acida.
Sebbene gli ossidi non metallici siano anche chiamati ossidi acidi, non tutti reagiscono sempre come acidi contro altri composti. In considerazione di ciò, tre diversi tipi di ossidi non metallici possono essere identificati in base alle loro proprietà acido/base:
Ossidi di acido non metallico
Sono i più comuni. La stragrande maggioranza dei composti tra ossigeno e un altro non metal, indipendentemente dal loro stato di ossidazione, produce acidi minerali quando li dissolve in acqua, dando origine a soluzioni acide.
- Alcuni esempi di ossidi acidi sono anidride nitrica (n2O5) e l'anidride solforica (SO3).
Ossidi non metallici neutri
Alcuni ossidi non metallici non reagiscono affatto con l'acqua quando si dissolvono in esso. In questi casi, la soluzione risultante è neutra (non è né acida né base).
- Alcuni esempi di ossidi neutri sono il monossido di carbonio (CO), l'ossido di azoto (N₂O) e il biossido di cloro (CLO2).
Ossidi anfotori non metallici
Il termine Anfótero Si riferisce alla capacità di un composto chimico di comportarsi come acido o come base, a seconda di chi reagisce. Cioè, questi sono composti che sono sia acidi che basi allo stesso tempo.
- Tra gli ossidi anfotici non metallici, il più comune è l'acqua (h2O). L'acqua è anfotente, poiché è in grado di dare un protone a una base (che agisce come acido), ma è anche in grado di ricevere un protone di un acido (che agisce come base).
Esempi di ossidi non metallici
Gli ossidi non metallici più comuni di ciascun non metallo sono presentati di seguito, insieme alla sua formula molecolare, il suo nome secondo la nomenclatura sistematica dell'IUPAC, secondo la nomenclatura azionaria e secondo la tradizionale nomenclatura:
Ossidi di carbonio
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
Co | Monossido di carbonio | Ossido di carbonio (ii) | Anidride carboniosa |
CO2 | Diossido di carbonio | Ossido di carbonio (IV) | Anidride carbonica |
Ossido d'azoto
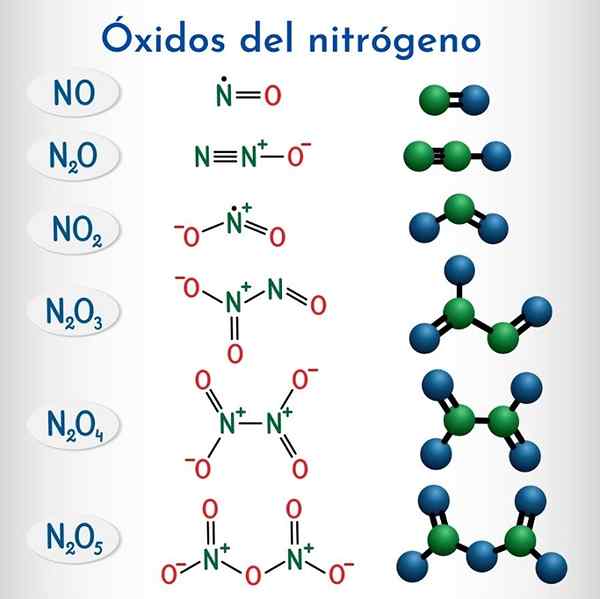 Formule e strutture dei 6 ossidi di azoto non metallici
Formule e strutture dei 6 ossidi di azoto non metallici Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
N2O | Monossido di dinitrogen | Ossido di azoto (i) | Ossido nitroso (Anidride hiponitroso) |
NO | Monossido di azoto | Ossido di azoto (II) | Monossido di azoto |
N2O3 | Triossido di dinitrogen | Ossido di azoto (III) | Anidride nitrosa |
N2O4 | Dinitrogen Tetraxide | Ossido di azoto (IV) | Tetraxide di azoto |
NO2 | Diossido di azoto | Ossido di azoto (IV) | Diossido di azoto |
N2O5 | Pentaossido di dinitrogeno | Ossido di azoto (V) | Anidride nitrica |
Ossidi di fosforo
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
P2O3 | Triossido di difosfacking | Ossido di fosforo (III) | Anidride di fosforo |
P2O5 | Pentaossido di difosphack | Ossido di fosforo (V) | Anidride fosforica |
P2O4 | Tetraxide difosphack | Ossido di fosforo (III, V) | --- |
Ossidi di arsenico
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
AS2O3 | Triossido diarsenico | Ossido di arsenico (III) | Anidride di arsenioso |
AS2O5 | Pentaossido diarsenico | Ossido di arsenico (V) | Anidride di arsenico |
Ossidi di antimonio
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
SB2O3 | Triossido di diantimo | Ossido di antimonio (III) | Anidride antimoniosa |
SB2O5 | Pentaossido di diantimo | Ossido di antimonio (V) | Anidride antimonica |
Ossidi di zolfo
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
SW | Monossido di zolfo | Ossido di zolfo (ii) | Anidride iposulful |
So2 | Diossido di zolfo | Ossido di zolfo (IV) | Anidride di zolfo |
So3 | Triossido di zolfo | Ossido di zolfo (VI) | Anidride solforica |
Ossidi di selenio
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
Seo | Selenio monossido | Ossido di selenio (II) | Anidride iplolina |
SEO2 | Biossido di selenio | Ossido di selenio (IV) | Anidride di selenario |
SEO3 | Triossido di selenio | Ossido di selenio (VI) | Anidride di selénic |
Telurio Oxides
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
Teo | Telurio Monossido | Telurio Ossido (II) | Anidride ipelugo |
Teo2 | Biossido di teluro | Telurio Ossido (IV) | Anidride telluosa |
Teo3 | Triurio Triossido | Telurio Ossido (VI) | Anidride telluica |
Ossidi di cloro
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
Cl2O | Monossido di cloro | Ossido di cloro (i) | Anidride ipoclorosa |
Cl2O3 | Triossido di cloro | Ossido di cloro (III) | Anidride di cloro |
Cl2O5 | Pentaossido di cloro | Ossido di cloro (V) | Anidride clorica |
Cl2O7 | Eptossido di cloro | Ossido di cloro (VII) | Anidride perclorica |
Ossidi di bromo
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
Br2o | Monossido di bromo | Ossido di bromo (i) | Anidride hipobromosa |
BR2O3 | Triossido di bromo | Ossido di bromo (III) | Anidride bromosa |
BR2O5 | Pentaossido di bromo | Ossido di bromo (V) | Anidride bromica |
BR2O7 | Eptaossido di bromo | Ossido di bromo (VII) | Anidride perbromica |
Ossidi di iodio
Formula | Nome sistematico Iupac | Nomenclatura di stock | Nome tradizionale |
I2o | Monossido di iodio | Ossido di iodio (i) | Anidride ipoyodoso |
I2o3 | Triossido di iodio | Ossido di iodio (iii) | Anidride di Yodoso |
I2o5 | Pentaossido di iodio | Ossido di iodio (V) | Anidride di yodium |
I2o7 | Eptossido di iodio | Ossido di iodio (vii) | Anidride periódicoica |

