Ossidi di base

- 3157
- 775
- Lidia Valentini
Spieghiamo quali sono gli ossidi di base, come si formano le loro proprietà, la nomenclatura e diamo diversi esempi,
 Molti ossidi di base hanno sorprendenti, caratteristici dei colori metallici
Molti ossidi di base hanno sorprendenti, caratteristici dei colori metallici Cosa sono gli ossidi di base?
IL ossidi di base Sono composti inorganici che sono formati dall'unione tra ossigeno e metallo. Sono chiamati ossidi di base perché producono soluzioni alcaline o di base durante la dissoluzione in acqua. Anche perché reagiscono con gli acidi per formare un sale e acqua attraverso una reazione di neutralizzazione a base di acido.
Gli ossidi di base sono molto comuni. In effetti, la maggior parte dei metalli in natura si trovano negli ossidi, quindi erano chiamati terreni.
Gli ossidi di base sono di grande importanza per l'industria. Molti pigmenti colorati utilizzati nel settore sono ossidi. Altri ossidi sono usati come base per dipinti, in particolare titanio, piombo e ossidi di zinco.
Proprietà degli ossidi di base
Sono composti binari
Questi composti sono formati solo da due elementi: ossigeno e metallo. Pertanto, sono composti binari.
La sua formula empirica è m2OX o moX/2
La valenza dell'ossigeno negli ossidi è sempre -2, quindi le formule empiriche degli ossidi sono semplificate quando il valencia del metallo è un numero di coppia. Tuttavia, lo stesso non accade quando è strano.
Ad esempio, la formula empirica di ossido di sodio è Na2O perché il sodio ha Valencia +1 (dispari). Invece, la formula empirica di ossido di calcio è CAO, poiché il calcio ha Valencia +2.
Sono composti inorganici, quasi sempre ionici
La maggior parte degli ossidi di base sono composti ionici cristallini. Ciò include gli ossidi di tutti i metalli alcalini, di tutti gli alcalini (ad eccezione del berillio) e la prima serie di metalli di transizione.
Può servirti: legame chimicoHanno punti di fusione e bollitura molto alti
Il legame ionico mantiene tutti gli ioni che formano ossidi di base fortemente uniti. Questo li rende difficili da sciogliere e ancora più difficili da vaporizzare. Per questo motivo, hanno punti di fusione e bollitura molto alti.
Sono solidi a temperatura ambiente
A causa dello stesso fatto di avere alti punti di fusione, tutti gli ossidi di base sono solidi a temperatura ambiente.
Sono composti di base
Il motivo per cui sono chiamati ossidi di base è proprio a causa delle sue proprietà a base di acido. Gli ossidi con maggiore carattere ionico producono soluzioni di base quando si dissolvono in acqua e reagiscono anche con acidi, neutralizzandoli.
Tuttavia, va notato che non tutti gli ossidi metallici sono basilari. Alcuni sono neutri, altri acidi e altri anfotori.
La maggior parte sono poco solubili o insolubili in acqua
Tutti gli ossidi di base sono insolubili in acqua, ad eccezione degli ossidi di metalli alcalini e bario. Tuttavia, sono solubili in soluzioni acide.
Come sono gli ossidi di base?
Gli ossidi di base possono essere formati spontaneamente quando i metalli sono esposti all'ossigeno dell'aria. In effetti, gli strati di corrosione che sono formati sulla superficie dei metalli sono costituiti da diversi ossidi di base.
Il metallo coinvolto, in generale è un metallo alcalino, alcalino o un metallo di transizione.
Puoi scrivere tre reazioni generali per la formazione di ossidi, a seconda che il valencia del metallo sia uniforme o dispari:
Per metalli con valenze dispari:
Quando il metallo ha una strana valenza, la reazione generale della formazione di ossido è:

Ad esempio, per la formazione di ossido di sodio, dove il sodio ha valencia +1, la reazione è:
Può servirti: fosforo: storia, proprietà, struttura, ottenimento, usi
Un altro esempio è la formazione di ossido ferrico, in cui il ferro ha ossidazione o valencia +3. In questo caso, la reazione è:

Per i metalli con Valencia +2:
Quando il metallo ha Valencia +2, la reazione generale della formazione di ossido è:

Ad esempio, nel caso della formazione di ossido di calcio, in cui il calcio ha Valencia +2, la reazione è:

Per metalli con altre coppie:
Quando il metallo ha anche valenze oltre a +2, la reazione generale della formazione di ossido è:
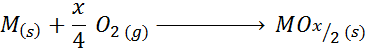
Un esempio di questo caso è la reazione di formazione di ossido di titanio (IV):

Nomenclatura degli ossidi di base
Esistono tre sistemi di nomenclatura per gli ossidi di base che sono: la nomenclatura tradizionale, lo stock e il sistematico.
Per nominare un ossido secondo i primi due sistemi di nomenclatura è necessario conoscere il valencia del metallo, mentre per l'ultimo.
Nomenclatura tradizionale
Secondo la nomenclatura tradizionale, gli ossidi di base sono nominati a partire dalla parola OXIDO seguito dal nome cationico. Questo cognome è costruito posizionando la radice del nome metallico e un sistema di prefissi e suffissi indicati dal valencia metallica:
Ossido + Prefisso-raí-sufijo
Le regole per l'assegnazione di prefissi e suffissi sono riassunte nella seguente tabella:
Numero di possibili valenze | Valencia | Prefisso | Suffisso |
1 singolo Valencia | |||
Soltanto | --- | ___ico | |
2 Valencias | |||
Anziano | --- | ___ico | |
Minore | --- | ___orso | |
3 valenze | |||
Anziano | --- | ___ico | |
Intermedio | --- | ___orso | |
Minore | Singhiozzo___ | ___orso | |
4 valenze | |||
Anziano | Per___ | ___ico | |
Maggiore intermedio | --- | ___ico | |
Intermedio minore | --- | ___ico | |
Minore | Singhiozzo___ | ___ico |
Esempio:
Lui Fede2O3 È un ossido di ferro con Valencia +3. Il ferro ha solo due valenze che sono +2 e +3, quindi in questo ossido il ferro ha il più vecchio di due valenze. Per questo motivo, viene aggiunto il suffisso ___ico alla radice del nome del metallo di ferro che è Ferr-.
Può servirti: nessun elettroliti: caratteristiche ed esempiPertanto, il nome tradizionale di Fede2O3 È: Ossido ferrico.
Nomenclatura di stock
In questo sistema, il nome è creato a partire dalle parole ossido Di, seguito dal nome metallico. Infine, il suo Valencia è posto in numero romano tra parentesi:
Metal + Nome Ossido (Valencia)
Nel caso in cui il metallo abbia solo una valenza, viene omesso.
Esempio:
In cr2O3 Il cromo ha Valencia +3, quindi lo stock di nome è Ossido cromatico (III).
Nomenclatura sistematica
Questa è l'unica delle tre nomenclature che non specifica il valencia metallica. I nomi sitematici indicano quanti atomi di ossigeno e metallo contengono il composto usando prefissi numerici.
Il nome è costruito con la parola ossido preceduto da lui Prefisso che indica il numero di ossigeno, Quindi l'articolo Di seguito da Nome metallico con il rispettivo prefisso.
Prefisso ossido + di + prefisso-metal
Alcuni prefissi sono:
Numero | Prefisso |
1 | Panino |
2 | Ha dato |
3 | Tri |
4 | Tetra |
5 | Penta .. |
Esempio:
Nella nomenclatura sistematica, il CR2O3 Si chiama triossido di dicroma, poiché ha tre ossigeno e due Chromos.
Esempi di ossidi di base
- Ossido di sodio - na2O
- Ossido ferrico - fede2O3
- Monossido di ferro - Brutto
- Ossido cromico - cr2O3
- Pentaossido di divanadio - V2O5
- Ossido di potassio - K2O
- Bario ossido - bao

