Ossido di potassio (K2O)
- 4600
- 668
- Brigitta Ferrari
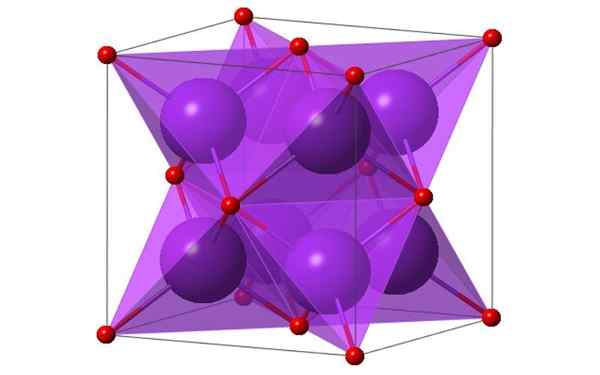
 Design cubico di 4 molecole di ossido di potassio. Fonte: Ktlabe, Wikimedia Commons
Design cubico di 4 molecole di ossido di potassio. Fonte: Ktlabe, Wikimedia Commons Cos'è l'ossido di potassio?
Lui ossido di potassio, Chiamato anche ossido di dipotasium, è un ossigeno ionico e sale di potassio, con la formula K2O. È l'ossido di potassio più semplice, altamente reattivo e raramente trovato. Alcuni materiali commerciali, come fertilizzanti e cemento2O.
L'ossido di potassio è prodotto da idrossido di potassio (potassa caustica) e potassio metallico a 450 ° C, producendo idrogeno molecolare in base all'equazione:
2K + 2KOH ⇌ 2K2O + h2 (450 ° C).
Si ottiene anche riducendo il perossido di potassio secondo la reazione:
2k2O2 → k2O + o2 (530 ° C).
Un altro metodo per ottenere ossido di potassio è riscaldando il carbonato di potassio ad alta temperatura, come indicato dalla seguente reazione:
K2Co3 ⇌ k2O + CO₂ (T> 1200 ° C).
Tuttavia, il modo principale per ottenere ossido di potassio è il riscaldamento del nitrato di potassio, ottenendo azoto molecolare come indicato dalla seguente reazione:
2kno3 + 10K → 6K2O + n2
Proprietà fisiche e chimiche
- Sono cristalli tetraedrici, giallastri, senza aroma caratteristica.
- Ha un peso molecolare di 94,2 g/mol e una densità di 2,13 g/ml a 24 ° C.
- Ha un punto di fusione di 740 ° C, sebbene inizi a decomporsi a 300 ° C.
- È resistente al calore e al solubile in etanolo ed etere. K2O cristallizza nella struttura antifluorita. Per questo motivo, le posizioni degli anioni e dei cationi sono investite in relazione alle loro posizioni nel CAF2, con ioni di potassio coordinati a 4 ioni di ossido e ioni di ossido coordinati a 8 potassio.
- È un ossido di base e reagisce violentemente con l'acqua per produrre idrossido di potassio caustico. È delicoscuale e assorbe l'acqua dall'atmosfera, iniziando questa vigorosa reazione.
Può servirti: nitrato di calcio (Ca (NO3) 2)- Si ossida in modo reversibile al perossido di potassio a 350 ° C, reagisce violentemente con acidi, come l'acido cloridrico, per formare sali di potassio secondo la reazione:
K2O + 2HCL → 2KCl + H₂O.
- Reagisce con il biossido di azoto per formare nitrato e nitrito di potassio a temperature tra 150 e 200 ° C:
K2O + 2no2 = Kno2 + Kno3
- Reagire a basse temperature con ammoniaca per formare Amidas e idrossido di potassio secondo la reazione:
K2O + NH3 (L) → kNH2↓ + KOH (-50 ° C).
Rischi
L'ossido di potassio è una sostanza instabile. Ossidi facilmente ossida altri ossidi di potassio, perossido o acido di potassio (KHO) (KHO). Il composto non è carburante, ma reagisce vigorosamente ed esotermicamente con acqua per formare idrossido di potassio (KOH).
La soluzione di ossido di potassio nell'acqua è una base forte, reagisce violentemente con l'acido ed è corrosiva. Reagisce violentemente con l'acqua che produce idrossido di potassio. Attacca molti metalli in presenza di acqua.
La sostanza è corrosiva per gli occhi, la pelle e le vie aeree, nonché l'ingestione. L'inalazione di aerosol può causare edema polmonare, i cui sintomi si manifestano spesso dopo poche ore e sono aggravati dallo sforzo fisico.
In caso di contatto visivo, è necessario verificare se vengono utilizzate le lenti a contatto e rimuoverle immediatamente. Gli occhi devono essere lavati con acqua corrente per almeno 15 minuti, con palpebre aperte. Può essere usata l'acqua fredda e non un unguento per gli occhi.
Se la sostanza chimica entra in contatto con i vestiti, mantienilo il più rapidamente possibile, proteggendo le proprie mani e il proprio corpo. Metti la vittima sotto una doccia di sicurezza.
Se la sostanza chimica si accumula nella pelle esposta, come le mani, la pelle contaminata da acqua corrente e sapone non abrasiva viene lavata dolcemente e attentamente. Può essere utilizzata l'acqua fredda. Se l'irritazione persiste, consultare il medico. Lavare i vestiti contaminati prima di usarli di nuovo.
Può servirti: Rubido: storia, proprietà, struttura, ottenimento, usiSe il contatto con la pelle è grave, dovrebbe essere lavato con un sapone disinfettante e coprire la pelle contaminata con una crema antibatterica.
In caso di inalazione, la vittima dovrebbe essere autorizzata a stare in un'area ben ventilata. Se l'inalazione è grave, la vittima deve essere evacuata in un'area sicura il più presto possibile.
Allentare abiti attillati, come colli di camicia, cinture o cravatta. Se la vittima è difficile da respirare, l'ossigeno deve essere somministrato. Se la vittima non respira, viene fatta una rianimazione della bocca.
Tenendo sempre conto che può essere pericoloso per la persona che fornisce aiuto per dare la rianimazione a bocca alla bocca quando il materiale inalato è tossico, infettivo o corrosivo.
In caso di ingestione, non induce vomito. Allentare i vestiti stretti. In tutti i casi, dovrebbero essere cercate cure mediche immediate.
Applicazioni
- La formula chimica K2O (o semplicemente k) è usato in diversi contesti industriali: numeri N-P-K per fertilizzanti, formule di cemento e formule di vetro.
Spesso non è usato direttamente in questi prodotti, ma la quantità di potassio è riportata in termini di k equivalente2O per qualsiasi tipo di composti di potassio utilizzato, come carbonato di potassio.
- L'ossido di potassio è di circa l'83% di potassio in peso, mentre il cloruro di potassio è solo del 52%. Il cloruro di potassio fornisce meno potassio di una parità di ossido di potassio.
Pertanto, se un fertilizzante è cloruro di potassio al 30% in peso, il suo indice di potassio standard, basato sull'ossido di potassio, sarebbe solo del 18,8%. È prodotto e/o tra 10 e 100 tonnellate all'anno di questa sostanza nello spazio economico europeo.
Può servirti: chimica nella vita di tutti i giorni: +30 esempi- Questa sostanza viene utilizzata in prodotti chimici, fertilizzanti, polimeri e prodotti fitosanitari di laboratorio. Il k2O Ha un uso industriale che si traduce nella produzione di un'altra sostanza (uso di prodotti intermedi).
- L'ossido di potassio viene utilizzato nelle aree di miscela e/o agricoltura, silvicoltura e formulazione della pesca. Viene utilizzato per la produzione di sostanze chimiche, prodotti in plastica e prodotti minerali (ad esempio gemelli, cemento).
- Viene utilizzato all'aperto in materiali a lungo termine con rilascio a bassa velocità, ad esempio materiali da costruzione in metallo, legno e plastica.
- I materiali interni, a lungo termine vengono utilizzati a bassa velocità di rilascio, come mobili, giocattoli, materiali da costruzione, tende, calzature, prodotti in pelle, prodotti di carta e cartone, attrezzature elettroniche.
- Questa sostanza può essere trovata in prodotti con materiale a base di pietra, intonaco, cemento, vetro o ceramica (ad esempio piastre, pentole / padelle, contenitori per la conservazione degli alimenti, costruzione e materiale isolante).
- L'ossido di potassio è una fonte termicamente stabile e altamente insolubile, adatta per applicazioni di vetro, ottico e ceramico. I composti di ossido non conducono elettricità.
- Viene anche utilizzato nei componenti strutturali della luce in applicazioni aerospaziali ed elettrochimiche come le batterie del carburante in cui presenta la conducibilità ionica.
Riferimenti
- Elementi americani (s.F.). Ossido di potassio. Recuperato dagli americani.com.
- Ossido di dipassio. Recuperato da Echa.Europa.Unione Europea.

