Ossido di fosforo (V) Struttura, proprietà, ottenimento, usi, rischi

- 2630
- 761
- Dott. Rodolfo Gatti
Lui Ossido di fosforo (V) È un solido inorganico formato da fosforo (P) e ossigeno (O). La sua formula empirica è p2O5, mentre la sua corretta formula molecolare è p4O10. È un solido bianco molto igroscopico, cioè può assorbire l'aria dall'aria molto facilmente, reagendo immediatamente con questo. La reazione può essere pericolosa perché provoca un rapido aumento della temperatura.
La sua alta tendenza ad assorbire l'acqua lo ha fatto usare come agente di essiccazione nei laboratori chimici, oltre a disidratare alcuni composti, cioè per eliminare l'acqua dalle sue molecole.
 Polvere di ossido di fosforo (V), p4O10. Lhchem [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Polvere di ossido di fosforo (V), p4O10. Lhchem [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. L'ossido di fosforo (V) viene anche usato per accelerare le reazioni di legame delle molecole di vari idrocarburi, essendo una reazione chiamata condensa. Inoltre, consente di convertire determinati acidi organici in esteri.
È stato usato ad esempio per perfezionare la benzina, per preparare l'acido fosforico H3Po4, Per ottenere composti che servono a ritardare il fuoco, per produrre vetro per applicazioni a vuoto, tra molti altri usi.
L'ossido di fosforo (V) deve essere mantenuto in contenitori ben chiusi per evitare il contatto con l'umidità dall'aria. È corrosivo e può danneggiare gli occhi, la pelle e il muco.
[TOC]
Struttura
L'ossido di fosforo (V) è formato da fosforo (P) e ossigeno (O), dove il fosforo ha valenza di +5 e ossigeno -2. La molecola di ossido di fosforo (V) ha quattro fosforo e dieci atomi di ossigeno ed è per questo che la sua formula molecolare corretta è p è p4O10.
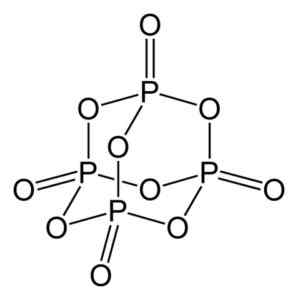 Struttura della molecola di ossido di fosforo (V), P4O10. Autore: Benjah-BMM27. Fonte: Wikimedia Commons.
Struttura della molecola di ossido di fosforo (V), P4O10. Autore: Benjah-BMM27. Fonte: Wikimedia Commons. Esiste in tre forme cristalline, come la polvere amorfa e in forma vitrea (come il vetro). Nella forma esagonale cristallina, ciascuno degli atomi di fosforo si trova nei vertici di un tetraedro.
Nomenclatura
- Ossido di fosforo (V)
- Pentossido di fosforo
- Pentossido di difosphack
Può servirti: solvente: concetto, tipi ed esempi- Pentossido fosforico
- Anidride fosforica
- Decadimento del tetrafosforo
Proprietà
Stato fisico
Solido bianco cristallino. La forma più comune è quella dei cristalli esagonali.
Peso molecolare
283,89 g/mol
Punto di fusione
562 ºC
Temperatura di sublimazione
Atmosfera da 360 ºC a 1 pressione. Significa che a questa temperatura passa dal solido del gas senza passare attraverso lo stato liquido.
Densità
2,30 g/cm3
Solubilità
Molto solubile in acqua. Acido solforico solubile. Insolubile in acetone e ammoniaca.
Proprietà chimiche
L'ossido di fosforo (V) si assorbe e reagisce con l'aria dall'aria con acido fosforico estremo che forma rapidamente H3Po4. Questa reazione è esotermica, il che significa che il calore viene prodotto durante lo stesso.
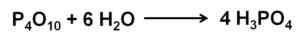 Reazione di ossido di fosforo (V) con acqua per formare l'acido fosforico H3Po4. Autore: Marilú Stea.
Reazione di ossido di fosforo (V) con acqua per formare l'acido fosforico H3Po4. Autore: Marilú Stea. La reazione di p4O10 con l'acqua porta alla formazione di una miscela di acidi fosforici la cui composizione dipende dalla quantità di acqua e condizioni.
La reazione con gli alcoli porta alla formazione di esteri di acido fosforico o acido polimerico a seconda delle condizioni sperimentali.
P4O10 + 6 ROH → 2 (RO)2Po.Oh + 2 ro.PO (OH)2
Con ossidi di base formano fosfati solidi.
È corrosivo. Può reagire pericolosamente con acido formico e basi inorganiche come idrossido di sodio (NaOH), ossido di calcio (CaO) o carbonato di sodio NA2Co3.
Se viene versata una soluzione di acido perclorico HCLO4 e cloroformio CHCL3 Nell'ossido di fosforo (V) P4O10 Si verifica un'esplosione violenta.
Altre proprietà
Non è infiammabile. Non favorisce la combustione. Tuttavia, la sua reazione d'acqua è così violenta ed esotermica che potrebbe esserci un rischio di incendio.
Ottenimento
Può essere preparato mediante ossidazione diretta del fosforo in una corrente di aria secca. Il fosforo quando il contatto in eccesso di ossigeno viene ossidato formando ossido di fosforo (V).
P4 + 5 o2 → p4O10
Presenza in natura
L'ossido di fosforo (V) si trova in minerali come Ilmenite, Rutilo e Zircón.
Può servirti: quali sono le funzioni chimiche inorganiche?L'ilmenite è un minerale che contiene ferro e titanio e talvolta ha ossido di fosforo (V) in concentrazioni che variano tra lo 0,04 e lo 0,33% in peso. Rutilo è un minerale di ossido di titanio e può contenere circa lo 0,02% in peso di p2O5.
Le sabbie zircón (un minerale di elemento zirconio) hanno ossido di fosforo (V) a 0,05-0,39% in peso.
Applicazioni
Come agente disidratante e secante
Per la sua grande avidità per l'acqua, è uno degli agenti disidratanti più noti ed efficaci a temperature inferiori a 100 ° C.
Può estrarre acqua da sostanze considerate agenti disidratanti. Ad esempio, è possibile rimuovere l'acqua dall'acido solforico H2SW4 rendendolo così3 e acido nitrico HNO3 trasformandolo in n2O5.
 Disidratazione dell'acido solforico a causa dell'ossido di fosforo (V). Autore: Marilú Stea.
Disidratazione dell'acido solforico a causa dell'ossido di fosforo (V). Autore: Marilú Stea. Fondamentalmente può asciugare tutti quei liquidi e gas con cui non reagisce, quindi consente di rimuovere tracce di umidità dai sistemi a vuoto.
Nelle reazioni di chimica organica
L'ossido di fosforo (V) serve a chiudere gli anelli di composti organici e altre reazioni di condensa.
Permette di sterilizzare gli acidi organici con la possibilità di distinguere tra acidi carbossilici alifatici primari (catena carbonizzata senza anelli con il gruppo -cooh ad un'estremità) e acidi aromatici (gruppo -coh collegato all'anello del benzene), poiché quest'ultimo non reagisce.
Serve anche a eliminare una molecola H2O degli amidas r (c = o) nh2 E li rende nitrili r-cn. Inoltre, catalizza o accelera l'ossigenazione, la deidrogenazione e la polimerizzazione delle reazioni di bitume.
 Il p4O10 È ampiamente utilizzato nei laboratori di chimica organica. Autore: JDN2001CN0. Fonte: Pixabay.
Il p4O10 È ampiamente utilizzato nei laboratori di chimica organica. Autore: JDN2001CN0. Fonte: Pixabay. Nel raffinazione del carburante
Dagli anni '30 del ventesimo secolo, alcuni studi hanno indicato che l'ossido di fosforo (V) esercitava un'azione di raffinazione del gas, aumentando il suo ottano.
L'azione di raffinazione di P4O10 È dovuto principalmente alle reazioni di condensa (unione di diverse molecole) e non di polimerizzazione (legame di molecole uguali).
Può servirti: acetato di sodio: struttura, proprietà, sintesi, usiIl p4O10 Accelera idrocarburi alomatici diretti con idrocarburi di olefina, conversione di olefina in nafthens e polimerizzazione parziale. La reazione di alchilazione aumenta il numero di ottano di benzina.
In questo modo si ottiene una benzina raffinata di alta qualità.
 Alcuni derivati dell'olio possono essere migliorati dall'azione di P4O10 Nelle sue molecole. Autore: drpeperscott230. Fonte: Pixabay.
Alcuni derivati dell'olio possono essere migliorati dall'azione di P4O10 Nelle sue molecole. Autore: drpeperscott230. Fonte: Pixabay. In varie applicazioni
L'ossido di fosforo (V) serve:
- Preparare l'acido fosforico H3Po4
- Ottieni esteri di acrilato e tensioattivo
- Preparare gli esteri fosfato usati come ritardanti di fiamma, solventi e diluenti
- Conversione del fosforo tricloruro in fosforo ossicloruro
- Reagente di laboratorio
- GRANDE SPECIALI SPECIALI PER TUBI VUOCO
- Aumenta il punto di fusione dell'asfalto
- Servire come molecola standard nella determinazione del fosforo o dei fosfati nella roccia fosfatica, ai fertilizzanti e al cemento di Portland, sotto forma di P2O5
- Migliora i collegamenti tra alcuni polimeri e lo strato di avorio che i denti possiedono
 Alcuni occhiali speciali come i tubi a vuoto devono usare p4O10 durante la sua produzione. Tvezymer [dominio pubblico]. Fonte: Wikimedia Commons.
Alcuni occhiali speciali come i tubi a vuoto devono usare p4O10 durante la sua produzione. Tvezymer [dominio pubblico]. Fonte: Wikimedia Commons. Rischi
L'ossido di fosforo (V) deve essere mantenuto in contenitori sigillati e in luoghi freschi, asciutti e ben ventilati.
Questo serve a impedirlo di non contattare l'acqua, in quanto può reagire violentemente con essa, generando molto calore, al punto di bruciare materiali vicini che sono combustibili.
La polvere di ossido di fosforo (V) è irritante per gli occhi e il tratto respiratorio e corrosivo per la pelle. Può produrre ustioni negli occhi. Per ingestione causano ustioni interne fatali.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Anidride fosforica. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Nayler, p. (2001). Bitumens: modificato. Modifica chimica. In Encyclopedia of Materials: Science and Technology. Recuperato da ScienceDirect.com.
- Malishev, b.W. (1936). Pentossido di fosforo come agente di raffinazione per la benzina. Chimica industriale e ingegneristica 1936, 28, 2, 190-193. Recuperato dai pub.sindrome coronarica acuta.org.
- Epps, jr. E.A. (1950). Determinazione fotometrica del pentossido di fosforo disponibile nei ferlizzatori. Chimica analitica 1950, 22, 8, 1062-1063. Recuperato dai pub.sindrome coronarica acuta.org.
- Banerjee, a. et al. (1983). Uso del pentossido di fosforo: esterificazione degli acidi organici. J. Org. Chimica. 1983, 48, 3108-3109. Recuperato dai pub.sindrome coronarica acuta.org.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Quarta edizione. John Wiley & Sons.
- Ogliari, f.A. et al. (2008). Sintesi di monomeri fosfato e legame alla dentina: metodi di esterificazione e uso del pentossido di fosforo. Journal of Dentistry, Volume 36, Numero 3, marzo 2008, Pagine 171-177. Recuperato da ScienceDirect.com.
- « Acetato in alluminio (AL (CH3CO) 3) Struttura, proprietà, usi
- Notazione ha sviluppato ciò che è, esempi ed esercizi »

