Struttura di ossido di stagno (ii), proprietà, nomenclatura, usi

- 2735
- 351
- Ruth Cattaneo
Lui ossido di stagno (ii) È un solido inorganico cristallino che è formato dall'ossidazione di stagno (SN) dall'ossigeno, dove Tin acquisisce Valencia 2+. La sua formula chimica è sno. Sono noti due modi diversi di questo composto: il nero e il rosso. La forma comune e più stabile a temperatura ambiente è la modifica del blu nero o nero.
Questa forma è preparata mediante idrolisi del cloruro di stagno (II) (SNCL2) In soluzione acquosa, a cui viene aggiunto l'idrossido di ammonio (NH4OH) per ottenere un precipitato di ossido idratato da Sn (ii) la cui formula è SNO.Xh2O, dove x<1 (x menor que 1).
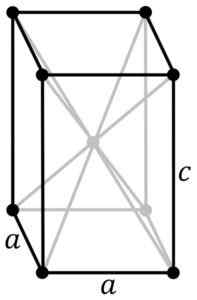 Struttura cristallina tetragonale dello sno blu nero. L'atomo SN si trova al centro della struttura e degli atomi di ossigeno nei vertici del parallelepiped. PNG originali dell'utente: Rocha, rintracciato in Inkcape dall'utente: Stannered [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]] Fonte: Wikipedia Commons
Struttura cristallina tetragonale dello sno blu nero. L'atomo SN si trova al centro della struttura e degli atomi di ossigeno nei vertici del parallelepiped. PNG originali dell'utente: Rocha, rintracciato in Inkcape dall'utente: Stannered [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]] Fonte: Wikipedia Commons L'ossido idratato è un solido amorfo bianco, che viene quindi riscaldato in sospensione a 60-70 ºC per diverse ore in presenza di NH4Oh, fino a quando non ottieni il black cristalline puro sno.
La forma rossa del sno è metastabile. Può essere preparato aggiungendo acido fosforico (h3Po4) - con acido fosforo del 22%, h3Po3 - E poi NH4Oh una soluzione Sncl2. Il solido bianco ottenuto viene riscaldato nella stessa soluzione a 90-100 ºC per circa 10 minuti. In questo modo si ottiene il sno cristallino rosso puro.
L'ossido di stagno (II) è un materiale di partenza per la produzione di altri composti di stagno (II). Per questo motivo, è uno dei composti di stagno che ha un'importanza commerciale apprezzabile.
L'ossido di stagno (II) presenta una bassa tossicità come con la maggior parte dei composti di stagno -inorganico. Ciò è dovuto al loro scarso assorbimento e alla rapida escrezione di tessuti viventi.
Può servirti: Bipe Beraral: a cosa serve, caratteristiche, a cosa servePresenta una delle più grandi tolleranze di composti di stagno nei test effettuati con ratti. Tuttavia, può essere dannoso se viene inalato in grandi quantità.
[TOC]
Struttura
Ossido di stagno (ii) blu nero
Questa modifica si cristallizza con la struttura tetragonale. Ha un livello di livello.
Altri ricercatori affermano che ogni atomo di SN è circondato da 5 atomi di ossigeno che sono approssimativamente nei vertici di un ottaedro, dove il sesto vertice è presumibilmente occupato da una coppia di elettroni liberi o non accoppiati. Questo è noto come la disposizione φ-ottica.
Ossido di stagno rosso (ii)
Questa forma di ossido di stagno (II) si cristallizza con struttura ortorrombica.
Nomenclatura
- Ossido di stagno (ii)
- Ossido di estany
- Monossido di stagno
- Ossido di estany
Proprietà
Stato fisico
Solido cristallino.
Peso molecolare
134,71 g/mol.
Punto di fusione
1080 ºC. Si decompone.
Densità
6,45 g/cm3
Solubilità
Insolubile in acqua fredda o calda. Insolubile in metanolo, ma si dissolve rapidamente in acidi e alcali concentrati.
Altre proprietà
Se più di 300 ºC viene riscaldato in presenza di aria, l'ossido di stagno (II) viene rapidamente ossidato nell'ossido di stagno (IV) che presenta l'incandescenza.
È stato riferito che in condizioni non ossidanti, il riscaldamento dell'ossido di stagno (II) ha vari risultati in base al grado di purezza dell'ossido iniziale. È generalmente sproporzionato in SN metallico e ossido di stagno (IV), SNO2, Con varie specie intermedie che finalmente diventano sno2.
L'ossido di stagno (II) è anfotero, in quanto è sciolto in acidi per dare ioni Sn2+ o complessi di anioni e si dissolve anche negli alcali per formare soluzioni ioniche per stanziamento dell'idrossi, SN (OH)3-, che hanno una struttura piramidale.
Può servirti: acido perclorico: formula, caratteristiche e usiInoltre, SNO è un agente riducente e reagisce rapidamente con acidi organici e minerali.
Presenta una bassa tossicità se rispetto ad altri sali di stagno. La sua DL50 (dose letale al 50% o dose letale medio) nei ratti è superiore a 10000 mg/kg. Ciò significa che sono necessari più di 10 grammi per chilogrammo per uccidere il 50% dei campioni di ratto in un determinato periodo di prova. In confronto, il fluoruro di stagno (II) presenta un 188 mg/kg DL50.
Tuttavia, se viene inalato per molto tempo, viene depositato nei polmoni perché non è assorbito e può produrre stagno (infiltrazione della polvere di sno negli interstizi polmonari).
Applicazioni
Nella produzione di altri composti di stagno (II)
La sua rapida reazione con gli acidi è la base del suo uso più importante, che è come intermediario nella produzione di altri composti di stagno.
È usato nella produzione di bromuro di stagno (II) (SNBR2), Stagno cianuro (ii) (SN (CN)2) e idrato fluoroborato di stagno (II) (SN (BF4)2), Tra gli altri composti di stagno (ii).
Tin Fluoroborate (II) viene preparato dissolvendo SNAM. Ciò è dovuto, tra le altre cose, alla sua alta capacità di copertura.
L'ossido di stagno (ii) viene utilizzato anche nella preparazione del solfato di stagno (ii) (SNSO4), per reazione SNO e acido solforico, h2SW4.
Lo snso4 Ottenuto, viene utilizzato nel processo in scatola per la produzione di piastre di circuiti stampati, per la finitura del contatto elettrico e per gli utensili da cucina.
Può servirti: carbonato di alluminio: struttura, proprietà, usi Circuito stampato. Nessun autore leggibile dalla macchina fornita. Abraham del Pozo assunto (basato su reclami di copyright). [Dominio pubblico] Fonte: Wikimedia Commons
Circuito stampato. Nessun autore leggibile dalla macchina fornita. Abraham del Pozo assunto (basato su reclami di copyright). [Dominio pubblico] Fonte: Wikimedia Commons La forma idratata dello sno, lo stagno idrotado (ii) sno.Xh2Oppure, è trattato con acido fluorhorico per ottenere fluoruro di stagno (II), SNF2, che viene aggiunto alle creme dentifric come agente per combattere la carie.
In gioielli
L'ossido di stagno (II) viene utilizzato nella preparazione di cristalli di intreccio d'oro e di rame. Apparentemente la sua funzione in questa applicazione è quella di agire come agente riducente.
 Gioiello con rubino. Fonte: Pixabay
Gioiello con rubino. Fonte: Pixabay Altri usi
È stato utilizzato nei dispositivi fotovoltaici per la produzione di elettricità dalla luce, come le celle solari.
 Dispositivo fotovoltaico. Georg Slickers [CC BY-SA 2.5 (https: // creativeCommons.Org/licenze/by-sa/2.5)] Fonte: Wikipedia Commons
Dispositivo fotovoltaico. Georg Slickers [CC BY-SA 2.5 (https: // creativeCommons.Org/licenze/by-sa/2.5)] Fonte: Wikipedia Commons Recenti innovazioni
Le nanoparticelle di snoro sono state utilizzate negli elettrodi di nanotubi di carbonio per batterie al litio-sullo zucchero.
 Nanofibre SNO idrate. Fionán [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Fonte: Wikipedia Commons
Nanofibre SNO idrate. Fionán [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Fonte: Wikipedia Commons Gli elettrodi preparati SNO presentano un'alta conducibilità e pochi cambiamenti di volume nel caricamento e nei cicli di download ripetitivi.
Inoltre, lo SNO facilita un rapido trasferimento di ioni/elettroni durante le reazioni di riduzione dell'ossidazione che si verificano in tale sistema di batterie.
Riferimenti
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Dance, j.C.; Emeléus, h.J.; Sir Ronald Nyholm e Trotman-Deckenson, a.F. (1973). Chimica inorganica completa. Volume 2. Pergamon Press.
- L'enciclopedia di chimica industriale di Ullmann. (1990). Quinta edizione. Volume A27. VCH Verlagsgellschaft MBH.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Volume 24. Quarta edizione. John Wiley & Sons.
- Ostrakhovitch, Elena a. E Cherian, M. Giorgio. (2007). Lattina. Nel manuale della tossicologia dei metalli. Terza edizione. Recuperato da ScienceDirect.com.
- Kwestroo, w. e vromani, p.H.G.M. (1967). Preparazione di tre modifiche di ossido di stagno puro (II). J. Inorg. Nucl. Chimica., 1967, vol.29, pp.2187-2190.
- Foud, s.S et al. (1992). Proprietà ottiche di film sottili di ossido stannio. Cecoslovacco Journal of Physics. Febbraio 1992, Volume 42, Numero 2. Recuperato da Springer.com.
- A-young Kim et al. (2017). Nanoparticelle SNO ordinate in MWCNT come materiale host funzionale per il catodo a batteria al litio-alforo ad alto tasso. Nano Research 2017, 10 (6). Recuperato da Springer.com.
- Biblioteca nazionale di medicina. (2019). Ossido stanna. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- « Jacquard Loom History, Operation, usi
- Funzionalismo (architettura) Storia, caratteristiche, opere »

