Trasformazioni della materia
- 4522
- 724
- Benedetta Rinaldi
 Le trasformazioni della materia sono quelle trasformazioni che soffrono senza cambiare la sua composizione. Ad esempio, l'acqua nella sua forma liquida, solida (ghiaccio) o soda (vapore) rimane acqua
Le trasformazioni della materia sono quelle trasformazioni che soffrono senza cambiare la sua composizione. Ad esempio, l'acqua nella sua forma liquida, solida (ghiaccio) o soda (vapore) rimane acqua Quali sono le trasformazioni della materia?
Le trasformazioni della materia sono le alterazioni che questo soffre senza la sua composizione che cambia. Cioè, la materia si trasforma quando passa attraverso cambiamenti fisici e chimici.
Esempi di cambiamenti fisici sono la formazione di ghiaccio quando la temperatura scende, la rugiada sulle foglie che appare al mattino, la dilatazione degli oggetti quando riscaldata e la magnetizzazione di un corpo.
Da parte sua, l'ossidazione di viti e chiodi è un cambiamento chimico, poiché l'ossido è una sostanza diversa dal ferro originale. In ogni caso, sono necessari cambiamenti di energia in modo che queste trasformazioni avvengano.
La trasformazione del ghiaccio è un cambiamento di stato in cui l'acqua si solidifica, ma ci sono più possibilità. La materia si verifica in natura e in laboratorio in vari stati, di cui gas, liquido e solido sono i tre più comuni, almeno in condizioni terrene.
Ma, dal momento che la materia sta cambiando, gli scienziati hanno incontrato più stati, di natura un po 'esotica, su base sperimentale e teorica.
Si può affermare che ci sono cinque stati fondamentali della materia:
- Solido
- Liquido
- Gas
- Plasma
- Condensa di bose-einstein
Di questi, i primi tre sono stabili nelle condizioni del nostro pianeta, mentre gli ultimi due richiedono mezzi tecnologici, sebbene nell'universo siano frequenti. Il plasma è, in effetti, lo stato più comune della materia nel cosmo.
Gli stati fondamentali della materia
Sotto le condizioni di pressione e temperatura della Terra, la materia è normalmente presentata in tre stati: solido, liquido e gas, mentre il plasma e gli stati di condensa di Bose-Einstein sono ottenuti in diverse condizioni, che possono essere raggiunti in laboratorio.
Può servirti: misure non convenzionaliPer spiegare perché, è necessario ricordare che la materia è composta da particelle, collegate attraverso le forze, sia attraenti che ripugnanti. Le forze di attrazione, come suggerisce il nome, tendono a mettere insieme le particelle, mentre quelle repulsive hanno l'effetto opposto.
Solidi, liquidi e gas
Quando le forze di attrazione prevalgono tra le particelle, rimangono vicine l'una all'altra, insieme in posizioni più o meno fisse, dando origine al solidi. Le particelle possono vibrare, ma non abbandonare la loro posizione all'interno del solido, quindi ciò mantiene una forma e un volume definiti.
Nel Liquidi, Le forze di attrazione consentono alle particelle di continuare in prossimità, ma sono meno intense rispetto ai solidi fornendo loro la possibilità di "scivolare" a vicenda in un certo modo. Per questo motivo, i liquidi adattano la loro forma al contenitore che li contiene, ma mantengono il loro volume fisso.
Finalmente, nel Gas, Le forze attraenti sono persino più deboli, prevalentemente repulsione. Questo fa sì che le particelle rimangono ben lontane l'una dall'altra e con molta più libertà di movimento. Per questo motivo, i gas si espandono fino a quando il volume disponibile non occupa completamente.
Bose-Einstein condensa e condensa
Da sufficientemente riscaldando gas, ioni ed elettroni si separano in un processo chiamato ionizzazione, In questo modo a plasma in laboratorio. Lo stato del plasma non è facile vedere naturalmente vicino alla terra, ma può essere visto da esso nelle luci settentrionali e meridionali.
Questo bellissimo fenomeno naturale si verifica quando le particelle del vento solare, un plasma piuttosto diffuso, influenzano l'atmosfera della Terra, ionizzante.
All'altra estremità della scala, raffreddando molto, appena sopra lo zero assoluto, appare un nuovo stato di materia in cui la maggior parte delle particelle si trova nello stato fondamentale, che è l'energia più bassa.
Può servirti: aspetto più importante della piccola scienza, della grande scienza e della tecnicaQuesto stato della materia è chiamato Condensa di bose-einstein, dai fisici Satyendra Bose e Albert Einstein, che hanno predetto la loro esistenza nel 1924.
Molti anni dopo, nel 1995, diversi scienziati sono riusciti a trasportare gas molto diluiti in questo stato, un compito facile, considerando che sono richieste temperature di soli nano-kelvin sopra lo zero assoluto.
Cambiamenti di stato nella questione
In natura, è molto comune per la materia passare da uno stato all'altro. Normalmente, questi cambiamenti fisici sono dovuti a variazioni di pressione e temperatura, derivate dall'aumento o dalla diminuzione dell'energia delle particelle.
Quando l'energia termica viene aggiunta a un materiale, aumenta l'energia cinetica delle sue particelle, riducendo la forza di attrazione che le mantiene in coesione. Se il materiale era allo stato solido, può quindi spostarsi allo stato liquido o addirittura andare direttamente allo stato gassoso.
Al contrario, rimuovendo abbastanza energia termica, è possibile far trasformare un materiale gassoso in liquido o che passi dal liquido al solido. In ogni caso, la composizione della sostanza non cambia.
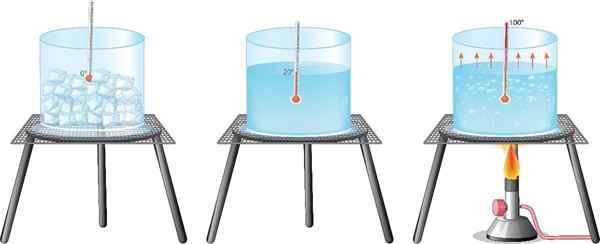
L'esempio più familiare per tutto è l'acqua: è noto che una porzione di acqua liquida viene trasformata in vapore quando viene bollita, mentre passa al ghiaccio raffreddarlo in un congelatore.
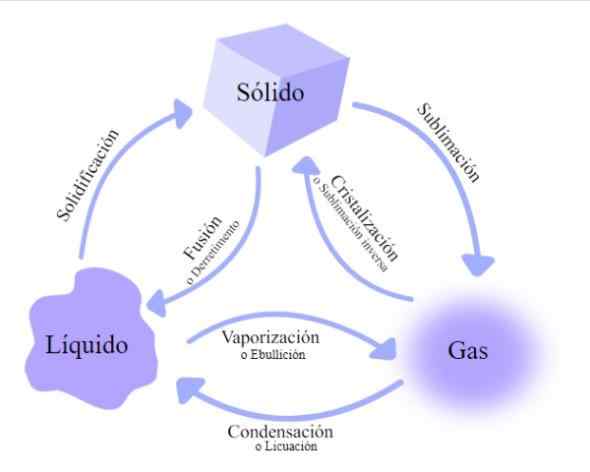 Cambiamenti nello stato della materia. Fonte: Wikimedia Commons
Cambiamenti nello stato della materia. Fonte: Wikimedia Commons Esistono diversi tassi di cambio attraverso i quali la materia passa, classificata in base al fatto che l'energia termica aumenti o diminuisca:
- Progressivo, Si svolgono quando il materiale assorbe l'energia termica.
- Regressivo, Sono quelli che si verificano quando il materiale produce energia.
Trasformazioni progressive
Tra le diverse trasformazioni progressive che si svolgono nella questione aggiungendo energia, ci sono:
Fusione
Cambiamento che si verifica quando il materiale passa dalla sua fase solida alla sua fase liquida. Ad esempio, sciogliendo un blocco di ghiaccio o calore o cera in una padella.
Vaporizzazione
In questo caso, la questione viene trasformata dallo stato liquido nello stato gassoso.
Può servirti: metodologiaLa vaporizzazione avviene in due modi:
- Bollente, avviene quando il materiale raggiunge il suo temperatura bollente, In questo modo, l'energia è sufficiente per superare le forze intermolecolari che mantengono le particelle nel loro stato liquido. Ogni sostanza ha una temperatura di ebollizione caratteristica, a una certa pressione.
- Evaporazione, Solo le particelle superficiali cambiano lo stato, poiché il materiale non è alla temperatura necessaria per entrare in ebollizione. L'esempio più noto è l'evaporazione dell'acqua lasciata in un contenitore, a temperatura ambiente.
Volatilizzazione
Chiamato anche sublimazione, Si svolge quando il materiale si converte direttamente dal solido del gas, senza passare attraverso la fase liquida.
Ad esempio, il ghiaccio secco è l'anidride carbonica2 volatilizzato a temperatura ambiente. Il naftalene, che viene utilizzato per proteggere i vestiti degli insetti, passa lentamente dall'essere solido all'essere un gas.
Ionizzazione
È il passaggio di un gas plasmatico.
Trasformazioni regressive
Sono le trasformazioni causate dalla diminuzione dell'energia termica delle particelle. Tra questi ci sono:
Solidificazione
È il cambio di materia dallo stato liquido al solido mediante raffreddamento, come accade quando si posiziona l'acqua nel congelatore. Il processo è perché la sostanza produce energia all'ambiente freddo, formando ghiaccio.
Condensazione
Si verifica quando si passa dallo stato gassoso alla fase liquida, come con il vapore acqueo nell'aria, quando si contatta il contatto con la superficie fredda del parabrezza dell'auto.
Liquefazione
È la trasformazione della materia quando si passa dal gas al liquido, come accade, raffreddando l'ammoniaca o l'anidride carbonica ad alta pressione.
Sublimazione inversa
Questo è il passaggio della materia in uno stato gassoso a solido, come con lo iodio gassoso che si scontra contro una superficie fredda, con conseguente formazione di cristalli solidi. È anche noto come cristallizzazione.
Desionizzazione
Cambio di stato plasmatico nello stato gassoso.
Riferimenti
- Chang, R. (2013). Chimica. 11va. Edizione. McGraw Hill Education.
- Giancoli, d. (2006 =. Fisica: principi con applicazioni. 6 °. Ed Prentice Hall.
- Materia e le sue proprietà. Recuperato da: elbibliote.com.
- Opentax. Chimica. Estratto da: OpenStax.org.
- Shipman, j. (2009). Un'introduzione alla scienza fisica. Dodicesima edizione. Brooks/Cole, Cengage Editions.

