Atomo neutro
- 4663
- 217
- Dante Morelli
Cos'è un atomo neutro?
UN atomo neutro È uno che manca di carica elettrica a causa della compensazione tra il numero dei suoi protoni ed elettroni. Entrambi sono particelle subatomiche caricate elettricamente.
I protoni sono agglomerati accanto ai neutroni e costituiscono il nucleo; Mentre gli elettroni sono sfocati definendo una nuvola elettronica. Quando il numero di protoni in un atomo, pari al suo numero atomico (Z), è uguale al numero di elettroni, si dice che vi sia una compensazione tra le cariche elettriche all'interno dell'atomo.
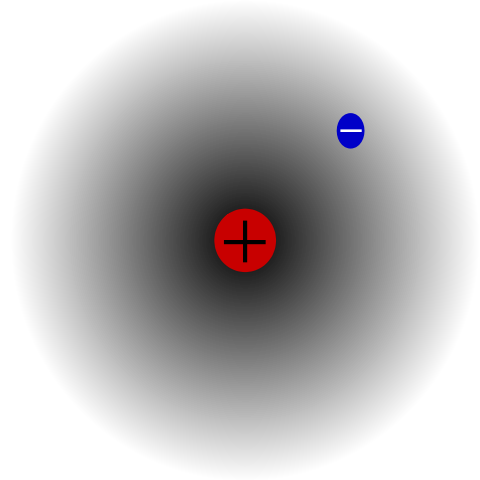
 Atomo di idrogeno. Fonte: Mets501 via Wikipedia.
Atomo di idrogeno. Fonte: Mets501 via Wikipedia. C'è ad esempio un atomo di idrogeno (immagine superiore), che ha un protone ed elettrone. Il protone è posizionato al centro dell'atomo come il suo nucleo, mentre l'elettrone orbita lo spazio circostante, lasciando regioni di minore densità elettronica mentre si allontana dal nucleo.
Questo è un atomo neutro perché è vero che z è uguale al numero di elettroni (1p = 1E). Se l'atomo di H avesse perso quel singolo protone, il raggio atomico veniva scrollato di spalle e prevarrebbe il carico del protone, diventando il cationico+ (Hydron). Se, d'altra parte, avesse vinto un elettrone, ci sarebbero due elettroni e diventerebbero anioni H-- (Idruro).
Atomo di ione neutro
Per l'esempio dell'atomo neutro di H, si è visto che si soddisfa che il numero di protoni sia uguale al numero di elettroni (1p = 1E); situazione che non accade con gli ioni derivati La perdita o il guadagno di un elettrone.
Gli ioni sono formati da un cambiamento nel numero di elettroni, sia perché l'atomo vince (-) o perderli (+).
Può servirti: fase dispersaNell'atomo del catione h+ Il Valencia del protone solitario predomina di fronte all'assenza totale di un elettrone (1p> 0e). Questo è vero per tutti gli altri atomi più pesanti (np> ne) della tabella periodica.
Sebbene la presenza di un onere positivo possa sembrare insignificante, cambia diagonalmente le caratteristiche dell'elemento in questione.
D'altra parte, nell'Atomo anionico H- Il carico negativo dei due elettroni predomina davanti all'unico protone del nucleo (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs Na+
Un esempio più noto è quello del sodio metallico. Il suo atomo neutro, Na, con z = 11, ha 11 protoni; Pertanto, ci devono essere 11 elettroni per compensare carichi positivi (11p = 11e).
Il sodio per essere un elemento metallico altamente elettropositivo, perde i suoi elettroni molto facilmente; In questo caso, perde solo uno, quello del suo strato di Valencia (11p> 10e). Pertanto, si forma il catione+, che interagisce elettrostaticamente con un anione; Come il cloruro, CL-, Nel sale sale sale, NaCl.
Il sodio metallico è velenoso e corrosivo, mentre il suo catione è persino presente all'interno delle cellule. Ciò dimostra come le proprietà di un elemento possano variare drasticamente quando vince o perde elettroni.
D'altra parte, il Nion na- (soro, ipoteticamente) non esiste; E per essere in grado di formarsi, sarebbe estremamente reattivo, poiché va contro la natura chimica del sodio per vincere elettroni. Poi un- Avrebbe 12 elettroni, superando la carica positiva del suo nucleo (11p<12e).
Può servirti: ossigeno molecolare: struttura, proprietà, usiMolecole neutre
Gli atomi sono collegati in modo covalente per dare origine a molecole, che il composto può anche essere chiamato. All'interno di una molecola non ci possono essere ioni isolati; Invece, ci sono atomi con carichi formali positivi o negativi. Questi atomi caricati influenzano il carico netto della molecola, trasformandolo in uno ione policimico.
Perché una molecola sia neutra, la somma dei carichi formali dei suoi atomi deve essere uguale a zero; O, più semplicemente, tutti i suoi atomi sono neutrali. Se gli atomi che compongono una molecola sono neutri, questo sarà anche.
Ad esempio, hai la molecola d'acqua, h2O. I suoi due atomi H sono neutri, proprio come l'atomo di ossigeno. Non possono essere rappresentati allo stesso modo come mostrato nell'immagine dell'atomo di idrogeno; Poiché, sebbene il nucleo non cambi, la nuvola elettronica lo fa.
Lo ione idronio, h3O+, D'altra parte, ha un atomo di ossigeno con carico parziale positivo. Ciò significa che in quello ione poliiatomico perde un elettrone e, quindi, il suo numero di protoni è maggiore di quello dei suoi elettroni.
Esempi di atomi neutri
Ossigeno
L'atomo di ossigeno neutro ha 8 protoni e 8 elettroni. Quando vince due elettroni, forma quello che è noto come anione di ossido, o2-. In esso, i carichi negativi predominano, con un eccesso di due elettroni (8p<10e).
Gli atomi di ossigeno neutro hanno un'alta tendenza a reagire e unirsi a se stessi per formarsi o2. È per questo motivo che non ci sono atomi o "sciolti" lì al tuo destino e senza reagire con nulla. Tutte le reazioni conosciute per questo gas sono assegnate all'ossigeno molecolare, o2.
Può servirti: metalli alkalinotherrousRame
Il rame ha 29 protoni e 29 elettroni (oltre ai neutroni). A differenza dell'ossigeno, i loro atomi neutri possono essere trovati in natura a causa del loro legame metallico e della stabilità relativa.
Come il sodio, tende a perdere elettroni invece di vincerli. Data la sua configurazione elettronica e altri aspetti, puoi perdere uno o due elettroni, diventando Cupros+, o cuprico, cu2+, rispettivamente.
Il Cucion Cu+ Ha un elettrone meno (29p<28e), y el Cu2+ ha perso due elettroni (29p<27e).
gas nobili
I gas nobili (lui, ne, ar, kr, xe, rn), sono uno dei pochi elementi che esistono nella forma dei loro atomi neutri. I suoi numeri atomici sono: 2, 10, 18, 36, 54 e 86, rispettivamente. Non vincono o perdono elettroni; Sebbene, xeno, XE, possa formare composti con fluoro e perdere elettroni.
Leghe di metallo
I metalli sono protetti dalla corrosione possono mantenere i loro atomi neutri, uniti da collegamenti metallici. Nelle leghe, soluzioni in metallo solido, gli atomi rimangono (principalmente) neutri. In ottone, ad esempio, ci sono atomi neutri di Cu e Zn.
Riferimenti
- Cos'è un atomo neutro? Recuperato da: Introduzione alla fisica.com
- Esempio di atomi non neutri. Scientifico. Recuperato da: scientifici.com

