Terza legge di formule termodinamiche, equazioni, esempi
- 4573
- 1264
- Kayla Serr
IL Terza legge della termodinamica afferma che l'entropia di un sistema termodinamico chiuso in equilibrio tende ad essere minima e costante, poiché la sua temperatura si avvicina 0 Kelvin.
Questo valore di entropia sarà indipendente dalle variabili del sistema (la pressione o il campo magnetico applicato, tra gli altri). Ciò che accade è che poiché la temperatura è più vicina a 0 K, i processi nel sistema vengono interrotti e come l'entropia è una misura dell'agitazione interna, scende necessariamente.
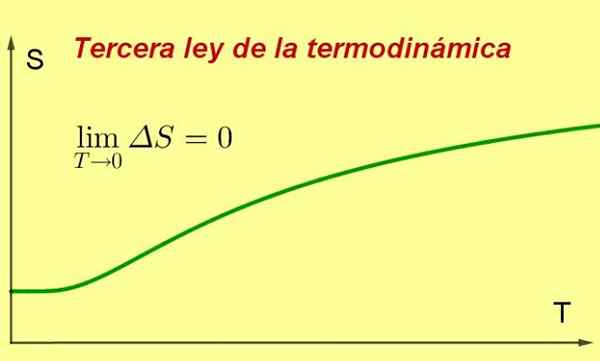
 Figura 1. Man mano che la temperatura di un sistema si avvicina allo zero assoluto, la sua entropia raggiunge un valore minimo e costante. Fonte: preparato da F. Zapata ..
Figura 1. Man mano che la temperatura di un sistema si avvicina allo zero assoluto, la sua entropia raggiunge un valore minimo e costante. Fonte: preparato da F. Zapata .. [TOC]
Concetti precedenti
Per comprendere la portata della terza legge della termodinamica, rilevante a temperature molto basse, è necessario rivedere i seguenti concetti:
Sistema termodinamico
Di solito si riferisce a un gas, a un liquido o a un solido. Quello che non fa parte del sistema viene chiamato in giro. Il sistema termodinamico più comune è il gas ideale, che è costituito da particelle N (atomi) che interagiscono solo attraverso le collisioni elastiche.
Sistemi isolati, chiusi o aperti
Ai sistemi isolati non è consentito alcun scambio con l'ambiente. I sistemi chiusi non scambiano importanti con l'ambiente ma calore. Infine, i sistemi aperti possono scambiare sia materia che calore con l'ambiente.
Macro -stato e microstato
La macro -stato di un sistema è l'insieme di valori che hanno le sue variabili: pressione, temperatura, volume, numero di moli, entropia ed energia interna. D'altra parte, la microesteem nel caso di un gas ideale è stato dato dalla posizione e dallo slancio di ciascuna delle particelle N che lo compongono, in un certo momento.
Molti microstati possono provocare lo stesso macro -stato. A gas ambiente a temperatura ambiente, il numero di possibili microstati è immenso, perché il numero di particelle che lo compongono, le diverse posizioni e le diverse energie che possono adottare è molto grande.
Formule ed equazioni
Entropia Come abbiamo detto, è una variabile macroscopica termodinamica che misura il sistema di disturbo molecolare del sistema. Il grado di disturbo di un sistema è maggiore nella misura in cui il numero di possibili microstati è maggiore.
Questo concetto è necessario per formulare la terza legge della termodinamica in forma matematica. Che si tratti dell'entropia del sistema, quindi:

L'entropia è una variabile di stato macroscopico che è direttamente correlata al numero di possibili microstati di un sistema, mediante la seguente formula:
S = k ln (w)
Nell'equazione precedente: S rappresenta l'entropia, W il numero di possibili microstati del sistema e K È costante di Boltzmann (K = 1.38 x 10-23 J/k). Cioè, l'entropia di un sistema è K volte il logaritmo naturale del numero di possibili microstati.
Calcolo dell'entropia assoluta di una sostanza
È possibile definire l'entropia assoluta di una sostanza pura in base alla definizione della variazione dell'entropia:

ΔQ = n . CP .Dt
Qui CP è il calore molare specifico e n il numero di moli. La dipendenza da calore specifica molare con la temperatura è un fatto sperimentalmente ottenuto e noto per molte sostanze pure.
Può servirti: sistema solare: pianeti, caratteristiche, origine, evoluzioneSecondo la terza legge nelle sostanze pure:
=0)
=\int_0^T\frac\overlinec_pdTT)
Applicazioni
Nella vita quotidiana, la terza legge della termodinamica ha poche applicazioni, piuttosto contrarie alla prima e alla seconda legge. È perché è un principio che si riferisce a ciò che accade in un sistema quando si avvicina allo 0 assoluto, un grado di rare temperature.
In effetti, raggiungere l'assoluto o -273,15 ° C è impossibile (vedere l'esempio 1 in seguito) Tuttavia, la terza legge viene applicata quando si studia la risposta dei materiali a temperature molto basse.
Grazie a ciò, sono emersi importanti progressi nella materia condensata, come: ad esempio:
-Superfluidità (vedi Esempio 2 più tardi)
-Superconduttività
-Tecniche di raffreddamento laser
-Condensa di bose-einstein
-Fermi Gas superflui.
 figura 2. Elio liquido superfluo. Fonte: Wikimedia Commons.
figura 2. Elio liquido superfluo. Fonte: Wikimedia Commons. A temperature estremamente basse, la discesa dell'entropia consente l'emergere di fenomeni quantici interessanti. Pertanto, vediamo cosa succede con l'entropia di un sistema di temperatura molto bassa.
Entropia di un sistema a bassa temperatura
Quando hai una sostanza cristallina perfetta, la sua entropia minima è esattamente zero, poiché è altamente ordinata. A temperature vicine allo 0 assoluto, la materia è in stato condensato (liquido o solido) e le vibrazioni di vetro sono minime.
Alcuni autori considerano una dichiarazione alternativa della terza legge della termodinamica quanto segue:
"Se la materia si condensa formando un cristallo perfetto, quando la temperatura tende a zero assoluto, l'entropia tende esattamente a zero".
Puntualizziamo alcuni aspetti dell'affermazione precedente:
- Un cristallo perfetto è quello in cui ogni molecola è identica e in cui la struttura molecolare viene ripetuta in modo identico nella sua interezza.
- Poiché la temperatura tende a zero assoluto, la vibrazione atomica diminuisce quasi completamente.
Quindi il vetro forma una singola possibile configurazione o micro -stato, vale a dire W = 1, E quindi l'entropia è uguale a zero:
S = k ln (1) = 0
Ma non finché un materiale raffreddato vicino allo zero assoluto forma un cristallo, tanto meno questo cristallo è perfetto. Ciò si verifica solo se il processo di raffreddamento è molto lento e reversibile.
Altrimenti, fattori come le impurità presenti nel vetro renderebbero possibile l'esistenza di altri microstati. Pertanto W> 1 e l'entropia sarebbe maggiore di 0.
Entropia residua
Se il processo di raffreddamento è brusco, allo stesso modo il sistema attraversa una successione di stati di manuperimento, il che porta al materiale da mostrare. In questo caso, non esiste una struttura cristallina e ordinata, ma un solido amorfo, la cui struttura è simile a quella di un liquido.
In tal caso, il valore di entropia minimo in prossimità dello zero assoluto non è zero, poiché il numero di microstati è molto maggiore di 1. La differenza tra questa entropia e l'entropia nulla del perfetto stato cristallino è nota come Entropia residua.
La spiegazione è che al di sotto di una certa temperatura di soglia, il sistema non ha altra possibilità che occupare.
Può servirti: prima legge della termodinamica: formule, equazioni, esempiSaranno responsabili del mantenimento dell'entropia costante, anche se la temperatura continua a scendere verso lo zero assoluto.
Esempi
Esempio 1: lo zero assoluto e l'indeterminazione di Heisenberg
Il principio di indeterminatezza di Heisenberg stabilisce che l'incertezza nella posizione e nel momento di una particella, ad esempio negli atomi di una rete cristallina, non è indipendente dall'altra, ma segui la seguente disuguaglianza:
Δx ⋅ ΔP ≥ h
Dove h è costante di Planck. Cioè, l'incertezza nella posizione moltiplicata per incertezza nel momento (massa per velocità) è maggiore o uguale alla costante di Planck, il cui valore è molto piccolo, ma non zero: H = 6.63 x 10-3. 4 J · s.
E cosa ha a che fare il principio di incertezza con la terza legge della termodinamica? Se la posizione degli atomi della rete cristallina è fissa e precisa (Δx = 0) Quindi la velocità di questi atomi può prendere qualsiasi valore tra 0 e l'infinito. Ciò è contraddetto dal fatto che in assoluto zero, ogni movimento di agitazione termica cessa.
Reciprocamente, se iniziamo a zero assoluto di temperatura, tutta l'agitazione cessa e lo slancio di ogni atomo della rete è esattamente zero (ΔP = 0), quindi il principio di incertezza di Heisenberg implicherebbe che l'indeterminatezza nelle posizioni di ciascun atomo sarebbe infinita, cioè possono essere in qualsiasi posizione.
Come conseguenza dell'istruzione precedente, il numero di microstati tenderebbe all'infinito e l'entropia prenderebbe anche un valore indeterminato.
Esempio 2: Superfluidità e lo strano caso di elio-4
Nella superflui, che si verifica a temperature molto basse, la materia perde l'attrito interno tra le sue molecole, chiamata sostanza vischiosa. In questo caso, il fluido potrebbe circolare senza attrito per sempre, ma il problema è a quelle temperature quasi nulla è liquido tranne l'elio.
Elio e elio 4 (il suo isotopo più abbondante) costituiscono un caso unico, poiché alla pressione atmosferica e alle temperature vicine allo zero assoluto, l'elio rimane liquido.
Quando l'elio-4 viene inviato a una temperatura inferiore a 2.2 k alla pressione atmosferica diventa a superfluo. Questa scoperta avvenne nel 1911 a Leyden dal fisico olandese Heike Kamerlingh Onnes (1853-1926).
 Figura 3. Il fisico olandese Heike Kamerlingh Onnes (1853-1926). Fonte: Wikimedia Commons.
Figura 3. Il fisico olandese Heike Kamerlingh Onnes (1853-1926). Fonte: Wikimedia Commons. Atom Helio-4 è un Bosón. I bosoni, a differenza dei fermioni, sono particelle che possono occupare lo stesso stato quantico. Pertanto i bosoni non soddisfano il principio di esclusione di Pauli.
Quindi tutti gli atomi di elio-4 a temperature inferiori a 2.2 k Occupare lo stesso stato quantico e quindi non c'è altro che un singolo possibile microstato, il che implica che il superfluo elio-4 ha s = 0.
Esercizi risolti
- Esercizio 1
Considera un semplice caso costituito da un sistema formato solo da tre particelle che hanno tre livelli di energia. Per questo semplice sistema:
a) Determinare il numero di microstato possibile per tre intervalli di temperatura:
-alto
-Metà
-Basso
b) Determinare attraverso l'entropia dell'equazione di Boltzmann nei diversi intervalli di temperatura.
c) Discutere i risultati e spiegare se contraddicare o meno la terza legge della termodinamica.
Soluzione a
Su una scala molecolare e atomica, le energie che un sistema può adottare sono quantizzate, il che significa che solo determinati valori discreti possono assumere. Inoltre, quando le temperature sono così basse, le particelle che compongono il sistema hanno solo la possibilità di occupare meno livelli di energia.
Può servirti: induzione magnetica: formule, come viene calcolata e esempiAlta temperatura
Se il sistema ha una temperatura relativamente elevata, le particelle hanno abbastanza energia per occupare eventuali livelli disponibili, dando origine a 10 possibili microstati, che appaiono nella figura seguente:
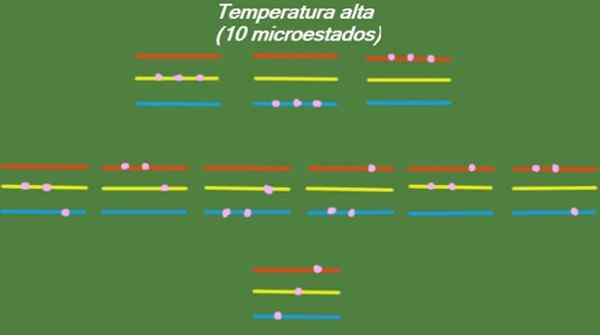 Figura 4. Possibili stati ad alta temperatura per l'anno risolto 1. Fonte: preparato da F. Zapata.
Figura 4. Possibili stati ad alta temperatura per l'anno risolto 1. Fonte: preparato da F. Zapata. Temperatura media
Nel caso in cui il sistema possieda una temperatura intermedia, le particelle che lo compongono non hanno abbastanza energia per occupare il più alto livello di energia. I possibili microstati sono illustrati nella figura:
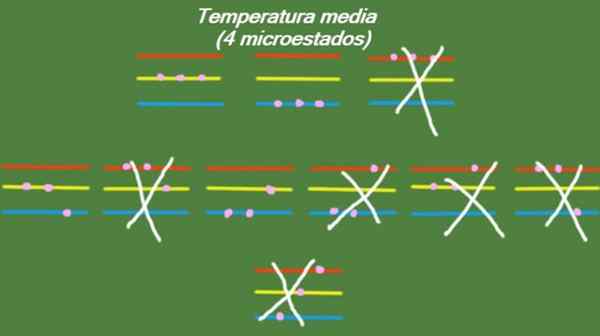 Figura 5. Micro -stato a temperatura media per il sistema di esercizi risolto 1. Fonte: preparato da F. Zapata.
Figura 5. Micro -stato a temperatura media per il sistema di esercizi risolto 1. Fonte: preparato da F. Zapata. Bassa temperatura
Se la temperatura continua a scendere nelle nostre tre particelle idealizzate e tre livelli di energia, le particelle avranno un'energia così piccola che potranno solo occupare il livello più basso. In questo caso, c'è solo 1 possibile microsta, come si può vedere nella Figura 6:
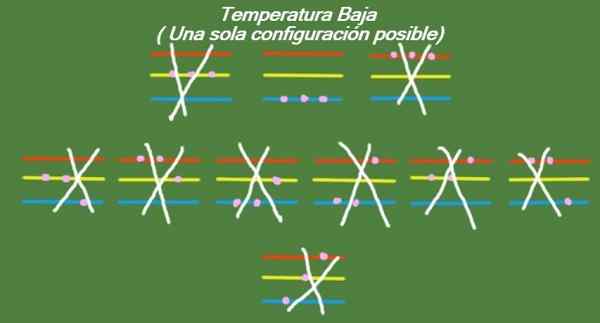 Figura 6. A bassa temperatura c'è una possibile configurazione (elaborazione propria)
Figura 6. A bassa temperatura c'è una possibile configurazione (elaborazione propria) Soluzione b
Già noto il numero di microstati in ciascun intervallo di temperatura, possiamo già utilizzare l'equazione di Boltzmann data in precedenza per trovare l'entropia in ciascun caso.
S = k ln (10) = 2.30 x k = 3.18 x 10-23 J/k (Alta temperatura)
S = k ln (4) = 1.38 x k = 1.92 x 10-23 J/k (Temperatura media)
E infine:
S = k ln (1) = 0 (Bassa temperatura)
Soluzione c
In primo luogo notiamo che l'entropia diminuisce quando la temperatura scende, come previsto. Ma per i valori di temperatura più bassi, viene raggiunto un valore di soglia, da cui viene raggiunto lo stato di base del sistema.
Anche se la temperatura è il più vicino possibile allo zero assoluto, non ci sono stati più piccoli disponibili. Quindi l'entropia mantiene il suo valore minimo costante, che nel nostro esempio è S = 0.
Questo esercizio illustra, a livello dei microstati di un sistema, il motivo per cui la terza legge della termodinamica è soddisfatta.
- Esercizio 2
Motivo se la prossima affermazione è vera o falsa:
"L'entropia di un sistema alla temperatura assoluta zero è esattamente zero".
Giustificare la risposta e descrivere alcuni esempi.
Soluzione
La risposta è: falso.
Innanzitutto la temperatura assoluta non può essere raggiunta perché il principio di incertezza di Heisenberg e la terza legge della termodinamica sarebbe violato.
È molto importante osservare che nella terza legge non si dice ciò che accade in assoluto 0, ma quando la temperatura è infinitamente vicina all'Assoluto 0. La differenza è sottile, ma significativa.
La terza legge non afferma che quando la temperatura prende un valore arbitrariamente vicino allo zero assoluto, l'entropia tende a zero. Ciò accadrebbe solo nel caso precedentemente analizzato: il cristallo perfetto, che è un'idealizzazione.
Molti sistemi di scala microscopica, ovvero su scala quantistica, hanno il loro livello di base di energia degenerare, Cosa significa l'esistenza di diverse configurazioni al livello di energia più basso.
Quanto sopra significa che in questi sistemi l'entropia non sarebbe mai esattamente zero. Né l'entropia sarebbe esattamente zero nei sistemi che vengono vetrificati quando la temperatura tende a zero assoluto. In questo caso, il Entropia residua Prima di vedere.
È perché le loro molecole erano "bloccate" prima di occupare i livelli più bassi di energia disponibili, il che aumenta considerevolmente il numero di possibili microstati, rendendo impossibile che l'entropia sia esattamente zero.
Riferimenti
- Cengel, e. 2012. Termodinamica. 7a edizione. McGraw Hill. 347.
- Laboratorio di propulsione a reazione. Il punto più bello dell'universo. Recuperato da: ColdAtomlab.JPL.vaso.Gov.
- González, a. Entropia e spontaneità. Recuperato da: Geocies.Ws
- Quora. Qual è l'uso pratico della terza legge della termodinamica?. Recuperato da: Quora.com
- Chimica generale. Terzo principio della termodinamica. Recuperato da: Corinth.Pucp.Edu.PE
- Terza legge della termodinamica. Recuperato da: YouTube.com
- Wikipedia. Residuo entropia. Recuperato da: in.Wikipedia.com
- Wikipedia. Terza legge della termodinamica. Recuperato da: in.Wikipedia.com
- « Quali incidenti si verificano più frequentemente nei bambini e negli adulti?
- Struttura dell'acido tricloroacetico, proprietà, sintesi, usi, effetti »

