Ether etil

- 1720
- 245
- Enzo De Angelis
 L'etere etil è un liquido volatile e infiammabile che è stato anestetico nel diciannovesimo secolo
L'etere etil è un liquido volatile e infiammabile che è stato anestetico nel diciannovesimo secolo Cos'è l'etere etilico?
Lui Ether etil, Conosciuto anche come dietel etere, è un composto organico la cui formula chimica è C4H10O. È caratterizzato dall'essere un liquido incolore e volatile e, quindi, le sue bottiglie devono essere chiuse il più strette possibile.
Questo etere. Cioè, hanno la formula ROR ', dove R e R' rappresentano diversi segmenti carbonizzati. E come descritto dal suo secondo nome, Diety Ether, sono due radicali -etil che sono collegati all'atomo di ossigeno.
Inizialmente, l'etere etilico era usato come anestetico generale, introdotto nel 1846 da William Thomas Green Morton. Tuttavia, a causa della sua infiammabilità, il suo uso è stato scartato, sostituendolo con altri anestetici meno pericolosi.
Questo composto è stato anche usato per calcolare il tempo di circolazione del sangue, durante la valutazione dello stato cardiovascolare del paziente.
Struttura dell'etere etilico
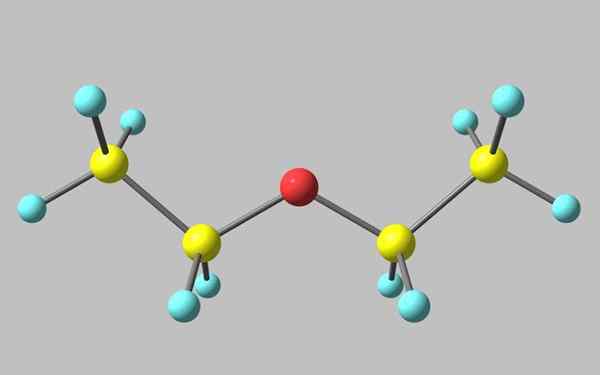 Struttura chimica dell'etere etilico
Struttura chimica dell'etere etilico Nell'immagine superiore c'è una rappresentazione con un modello di sfere e barre della struttura molecolare dell'etere etilico.
Come si può vedere, la sfera rossa, corrispondente all'atomo di ossigeno, ha due gruppi etilici legati a entrambi i lati. Tutti i collegamenti sono rotazioni semplici, flessibili e libere attorno agli assi σ.
Queste rotazioni hanno origine stereoisomeri noti come conformatori, che più degli isomeri sono stati spaziali alternativi. La struttura dell'immagine corrisponde esattamente all'antifontore, in cui tutti i suoi gruppi atomi sono sfalsati (separati l'uno dall'altro).
L'altro confruero è eclissata e sebbene non sia la sua immagine disponibile, è sufficiente visualizzarlo con una forma a U. Alle estremità superiori dell'U i gruppi metilici verrebbero posizionati, -CH3, che sperimenterebbero repulsioni steriche (si scontrerebbero nello spazio).
Può servirti: Faraday CostantPertanto, ci si può aspettare che la molecola di Cho3Cap2Och2Cap3 adottare l'anti formazione per la maggior parte del tempo.
Proprietà fisiche e chimiche del Ether etil
Altri nomi
- Etere dietilico
- Exytano
- Ossido di etile
Formula molecolare
C4H10O o (c2H5)2O.
Peso molecolare
74.14 g/mol.
Aspetto fisico
Liquido incolore.
Odore
Dolce e piccante.
Gusto
Brucia e dolce.
Punto di ebollizione
94.3 ° F (34.6 ° C) a 760 mm Hg.
Punto di fusione
-177.3 ° F (-116.3 ° C). Cristalli stabili.
punto di accensione
-49 ° F (contenitore chiuso).
Solubilità dell'acqua
6.04 g/100 ml a 25 ° C.
Solubilità in altri liquidi
Miscibile con allifatico a catena corta, benzene, cloroformio, etere di petrolio, solvente a grasso, molti oli e acido cloridrico concentrato.
Solubile in acetone e molto solubile in etanolo. È anche solubile in benzina, benzene e oli.
Densità
0.714 mg/ml a 68 ° F (20 ° C).
Densità del vapore
2.55 (in relazione all'aria presa con la densità 1).
Pressione del vapore
442 mm Hg a 68 ° F. 538 mm Hg a 25 ° C. 58,6 kPa a 20 ° C.
Stabilità
È lentamente ossidato dall'azione dell'aria, dell'umidità e della luce con la formazione di perossidi.
La formazione di perossidi può verificarsi in contenitori di etere che sono stati aperti e rimangono in deposito per più di sei mesi. I perossidi possono innescare attrito, impatto o riscaldamento.
Il suo contatto con: zinco, alogeni, oxihaluuros non metallici, forti agenti ossidanti, cloruro di cromil.
Auto -accensione
356 ° F (180 ° C).
Decomposizione
Quando si scalda si rompe, emettendo un acro e un fumo irritante.
Sostanza vischiosa
0.2448 equilibrio a 20 ° C.
Calore a combustione
8.807 kcal/g.
Può servirti: Einsenio (S): struttura, proprietà, ottenimento, usiCalore di vaporizzazione
89.8 calce/g a 30 ° C.
Tensione superficiale
17.06 dynas/cm a 20 ° C.
Potenziale di ionizzazione
9.53 eV.
Soglia di odore
0.83 ppm (la purezza non è data).
Indice di rifrazione
1.Da 355 a 15 ° C.
Ottenere il Ether etil
Può essere ottenuto l'etere etil dall'alcool etilico, in presenza di acido solforico come catalizzatore. L'acido solforico in un mezzo acquoso si dissociano che produce lo ione idronio, h3O+.
Nel processo opposto, cioè l'idratazione dell'etilene nella fase del vapore, l'etere etilico può formarsi come prodotto collaterale oltre all'alcool etilico. In effetti, questa via sintetica produce la maggior parte di questo composto organico.
Tossicità di Ether etil
Può produrre irritazioni per la pelle e gli occhi. Il contatto con la pelle può produrre la sua resezione e cracking. L'etere di solito non penetra nella pelle, poiché è rapidamente evaporato.
L'irritazione degli occhi causata dall'etere è generalmente lieve e, nel caso di grave irritazione, il danno è generalmente reversibile.
La sua ingestione produce effetti narcotici e irritazione allo stomaco. L'ingestione grave può causare danni ai reni.
L'inalazione di etere può causare irritazione al naso e alla gola. Nel caso di un'inalazione di etere, può essere prodotta: sonnolenza, eccitazione, vertigini, vomito, respirazione irregolare e aumento della salivazione.
L'elevata esposizione può causare perdita di conoscenza e persino la morte.
L'OSHA stabilisce in media un limite di esposizione al lavoro di 800 ppm, durante uno spostamento di 8 ore.
Livelli di irritazione degli occhi: 100 ppm (umani). Livelli di irritazione degli occhi: 1200 mg/m3 (400 ppm).
Usi/applicazioni del Ether etil
Solvente organico
È un solvente organico usato per dissolvere bromo, iodio e altri alogeni. La maggior parte dei lipidi (grassi), resine, gomme pure, alcuni alcaloidi, gomme, profumi, acetato di cellulosa, nitrato di cellulosa, idrocarburi e coloranti.
Può servirti: nessun metallo: storia, proprietà, gruppi, usiInoltre, viene utilizzato nell'estrazione degli ingredienti attivi dei tessuti animali e delle piante, perché ha meno densità rispetto all'acqua e ai galleggianti, lasciando le sostanze desiderate disciolte nell'eter.
Anestesia generale
È stato usato come anestetico generale dal 1840, sostituendo il cloroformio per avere un vantaggio terapeutico. Tuttavia, è una sostanza infiammabile e, quindi, trova gravi difficoltà nel suo uso all'interno delle aree cliniche.
Inoltre, produce in pazienti alcuni effetti collaterali postoperatori indesiderabili, come nausea e vomito.
Per questi motivi, l'uso dell'etere è stato scartato come anestetico generale, sostituendolo con altri anestetici come Halotano.
Spirito etere
Etanolo misto etere.
Valutazione della circolazione sanguigna
L'etere è stato usato per valutare la circolazione sanguigna tra un braccio e i polmoni. L'etere viene iniettato in un braccio, portando il sangue all'atrio destro, quindi al ventricolo destro e da lì ai polmoni.
Il tempo che trascorre dall'iniezione dell'etere, alla cattura dell'odore dell'etere nell'aria espirata, è di circa 4-6 s.
Laboratori di insegnamento
L'etere viene utilizzato nell'insegnamento dei laboratori in molti esperimenti. Ad esempio, nella dimostrazione delle leggi della genetica di Mendel.
L'etere viene utilizzato per intorpidire le mosche di genere Drosophila e consentire alle croci necessarie tra loro, per evidenziare le leggi della genetica.
Riferimenti
- Graham Solomons t.W., Craig b. Frigorifero. Chimica organica. Ammine. Wiley Plus.
- Ether Ether. Recuperato dalla Britannica.com

