Teoria orbitale molecolare

- 2955
- 228
- Benedetta Rinaldi
Cos'è la teoria orbitale molecolare?
IL Teoria orbitale molecolare (Tom) È un modello matematico sviluppato per spiegare le proprietà fisico -chimiche delle molecole, come l'assorbimento e l'emissione di radiazioni, conducibilità elettrica, nonché la natura elettronica dei suoi collegamenti. Ciò considera, a differenza della teoria dei collegamenti di Valencia (TEV), che gli elettroni vengono trasferiti in tutta la molecola, senza essere probabilisticamente posizionati nei collegamenti.
Pertanto, la teoria orbitale molecolare applica gli stessi principi quantistici che dettano le funzioni d'onda per gli orbitali atomici, descrivendo così lo stato energetico degli elettroni negli atomi; Solo ora, affronta gli orbitali molecolari così chiamati, originati dalle combinazioni lineari degli orbitali atomici degli atomi collegati.
 Il paramagnetismo dell'ossigeno liquido, e quindi la sua attrazione per i magneti, è spiegato grazie alla teoria orbitale molecolare. Fonte: Pieter Kuipeper via Wikipedia.
Il paramagnetismo dell'ossigeno liquido, e quindi la sua attrazione per i magneti, è spiegato grazie alla teoria orbitale molecolare. Fonte: Pieter Kuipeper via Wikipedia. La teoria orbitale molecolare funziona quindi, lavorando con orbitali molecolari, le loro distribuzioni elettroniche e spaziali, nonché i diagrammi delle loro rispettive energie, che consentono di osservare gli spazi di energia che le separano. Soprattutto, spiega il paramagnetismo di alcune sostanze, come l'ossigeno molecolare in stato liquido (vedi sopra).
Il o2, Descritto dalle strutture di Lewis e dalla teoria dei collegamenti di Valencia, ha tutti i suoi elettroni accoppiati, quindi in teoria dovrebbe essere diamagnetico. Tuttavia, in pratica è stato dimostrato che in realtà è paramagnetico, cioè ha elettroni mancanti; in particolare una coppia di elettroni mancanti.
Dalla costruzione del diagramma OM (orbitali molecolari) per O2, Una molecola diatomica omonucleare, si può vedere che ci saranno effettivamente due elettroni mancanti ad alta energia. Non solo questo, ma la rotazione e la posizione di questi elettroni negli OM spiegano anche altri stati elettronici di OR2 (separare).
Altri dei trionfi più importanti della teoria orbitale molecolare è che aiuta a prevedere la possibile esistenza delle molecole diatomiche, nonché la loro stabilità relativa. Pertanto, la teoria orbitale molecolare è giusta nella previsione di molecole come B2 e li2, Anche quando possono rilevare solo nella fase di vapore ad alte temperature. Inoltre, questa teoria rifiuta l'esistenza dell'ipotetico che ho2 o ne2.
Tipi di legami molecolari e orbitali
Come per la teoria dei collegamenti di Valencia, nella teoria orbitale molecolare, sono considerati diversi tipi di collegamenti a seconda della direzionalità della sovrapposizione degli orbitali atomici che partecipano al legame chimico. Tra i più importanti e presenti nella natura molecolare, abbiamo i legami Sigma e PI.
Sigma
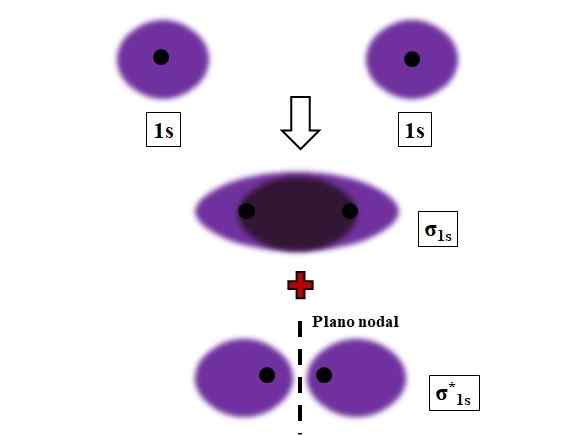 Formazione di collegamenti σ1s e σ1s* durante la sovrapposizione di due orbitali atomici 1s. Fonte: Gabriel Bolívar.
Formazione di collegamenti σ1s e σ1s* durante la sovrapposizione di due orbitali atomici 1s. Fonte: Gabriel Bolívar. Sigma, i legami σ vengono stabiliti quando gli orbitali atomici si sovrappongono frontalmente, in relazione a un'ascia internucleare immaginaria.
Considera, ad esempio, il collegamento σ che si forma quando due orbitali atomici 1S, secondo un atomo di idrogeno, sono vicini a una distanza molto breve (immagine sopra). Poiché gli orbitali 1 sono simmetrici, la loro sovrapposizione sarà sempre frontale; Pertanto, genereranno sempre orbitali molecolari σ1s e σ1s*.
Nota ora che molecolare orbitale σ1s mostra una densità elettronica concentrata nello spazio che separa i due nuclei. Ciò significa che in un orbitale σ1s La probabilità di trovare un elettrone è massima in questa regione della molecola. Gli elettroni di σ1s Sono trasferiti in tutto lo spazio che copre il colore viola.
D'altra parte, nell'orbitale σ1s* Abbiamo un piano nodale tra i due nuclei. Ciò significa che la probabilità di trovare un elettrone tra quello spazio è uguale a zero. Si noti che nell'orbitale σ1s* Gli elettroni descrivono posizioni attorno a ciascuno dei due nuclei; non intorno alla molecola nel suo insieme.
Può servirti: radio: struttura, proprietà, usi, ottenimentoPi
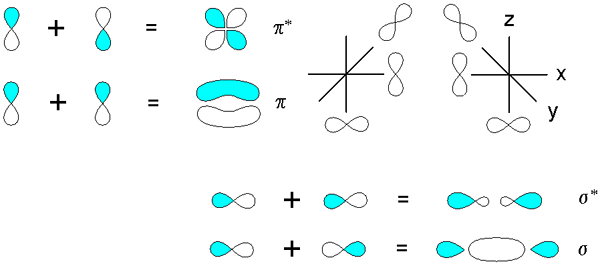 Legami sigma e pi derivati dalla sovrapposizione di orbitali p. Fonte: v8rik at in.Wikipedia, CC BY-SA 3.0, via Wikimedia Commons
Legami sigma e pi derivati dalla sovrapposizione di orbitali p. Fonte: v8rik at in.Wikipedia, CC BY-SA 3.0, via Wikimedia Commons Considera ora i legami molecolari e gli orbitali. Questi si verificano quando la sovrapposizione degli orbitali avviene in una direzione perpendicolare all'asse internucleare, che è arbitrariamente fissata in uno qualsiasi degli assi del piano cartesiano. Supponendo che stiamo parlando di un orbitale 2pX, L'orbitale 2pE Sarà libero di stabilire un collegamento PI (vedi lobi blu e bianchi).
Quando due orbitali 2pE Originano due orbitali molecolari: π2py e π2py*; Il primo ha la più alta densità elettronica e sotto l'asse internucleare, mentre il secondo ricorda un fiore a quattro palette, dove la probabilità di trovare elettroni è molto più bassa.
D'altra parte, gli orbitali 2p, per dire 2pX, Possono anche sovrapporre frontale per avere origine un legame σ e due orbitali molecolari σ2px e σ2px*. Come nei casi di σ1s e σ1s*, L'orbitale σ2px mostra una maggiore densità elettronica tra i due nuclei; che è contrario a σ2px*, dove gli elettroni sono orientati verso i lati dell'esterno.
Collegamento
Gli orbitali molecolari linding sono quelli che contribuiscono alla stabilità della molecola. Cioè, devono avere meno energia rispetto agli orbitali atomici dei singoli atomi prima di collegare e formare la molecola. In questi orbitali gli elettroni vengono trasferiti da tutte le dimensioni della molecola nel suo insieme.
Nei diagrammi OM, questi saranno sempre situati sotto gli orbitali atomici che si sono uniti per formarli. Questo sarà visto in modo più dettagliato nelle prossime sezioni.
Anti -hut
Gli orbitali molecolari anti -buoni, d'altra parte, sono quelli che destabilizzano la molecola. Sono simboleggiati con un asterisco (*) e le loro energie sono più alte di quelle degli orbitali atomici che li hanno originati. In questi orbitali gli elettroni vengono trasferiti in modo abbastanza irregolare, come se la molecola fosse frammentata elettronicamente.
Nei diagrammi OM, saranno sempre posizionati sopra gli orbitali atomici che si sono uniti per formarli.
Non collegato
Nel frattempo, gli orbitali non di sinistra, così come i loro elettroni, sono quelli che non contribuiscono o danneggiano la stabilità della molecola. Le sue energie sono molto simili a quelle degli orbitali atomici.
Ordine di collegamento
L'ordine di collegamento diventa nella teoria orbitale molecolare, così come il numero di collegamento è nella teoria dei collegamenti di Valencia: una misura della forza del collegamento in una molecola. Pertanto, un ordine di collegamento pari a 1 corrisponde a un semplice collegamento (-). E un ordine di collegamento (o.e) uguale a 2, corrisponde a un doppio legame (=). Presto.
Questo ordine è determinato dal conteggio degli elettroni nei diagrammi OM per una particolare molecola. Per fare ciò, deve essere applicata la seguente formula:
O.E = (numero di elettroni collegati - Numero di elettroni anti -hut)/2
Gli elettroni di collegamento contribuiscono alla molecola a stabilizzarsi, mentre gli elettroni anti -conduttori la destabilizzano. Pertanto, più elettroni anti -seme, più piccolo è.E, e la molecola tende ad essere molto instabile. Quando il o.E è uguale a 0, significa che la molecola non esiste (o almeno in teoria).
Diagrammi OM
Nei diagrammi OM sono rappresentate le energie degli orbitali molecolari e viene anche visualizzato il suo riempimento elettronico, il che obbedisce alle regole di Aufbauf e Sinn, nonché il principio di esclusione. Considera, ad esempio, i seguenti due diagrammi:
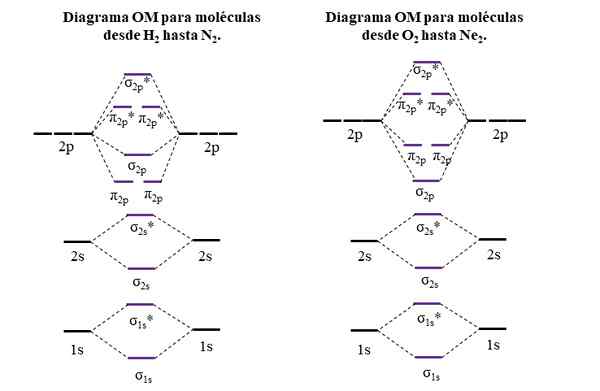 Diagrammi OM per molecole del primo e del secondo periodo della tabella periodica. Fonte: Gabriel Bolívar.
Diagrammi OM per molecole del primo e del secondo periodo della tabella periodica. Fonte: Gabriel Bolívar. Le linee orizzontali sui lati, nere, rappresentano le energie degli orbitali atomici. Invece, le linee orizzontali centrali, viola, sono le energie degli orbitali molecolari. Nota come sono distribuiti le OM di collegamento e anti -agenti (*) in relazione agli orbitali atomici dei singoli atomi.
Può servirti: un gruppo amminico (NH2): struttura, proprietà, esempiNota anche che nel diagramma giusto, l'OM σ2 p Cambiano posto con π2 p. Ciò si verifica con le molecole di O2, F2, e l'ipotetico NE2.
Esempi
Nei seguenti esempi, l'OM procederà con gli elettroni, calcolerà l'ordine di collegamento e farà previsioni sulla forza del legame o stabilità della molecola in questione.
H2
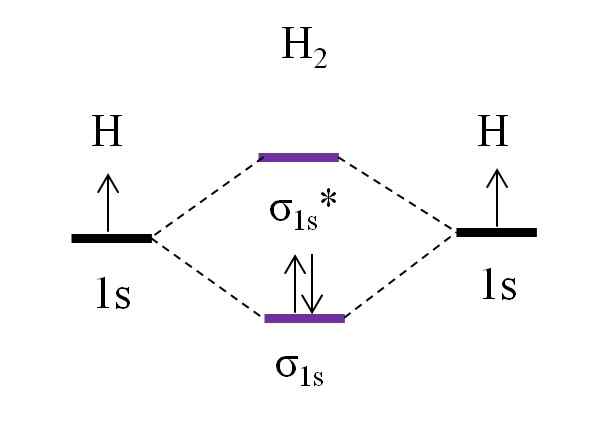 Diagramma OM per molecola di diidrogeno. Fonte: Gabriel Bolívar.
Diagramma OM per molecola di diidrogeno. Fonte: Gabriel Bolívar. A partire dalla molecola più semplice, quella del diidrogeno, h2, Due atomi H sono collegati combinando i loro due orbitali atomici 1S per formare due orbitali molecolari σ1s e σ1s*. I due elettroni procedono quindi a riempire gli orbitali molecolari.
Innanzitutto l'orbitale σ viene riempito1s, Perché è la minima energia (regola Aufbauf). Quindi, il secondo elettrone deve finire di riempire l'orbitale σ1s Prima di scalare l'orbitale σ1s* (Regola del lavandino). E infine, questo secondo elettrone guida la sua rotazione nella direzione opposta al primo elettrone (principio di esclusione di Pauling). Pertanto, i due elettroni si trovano nell'orbitale collegato σ1s.
Che dire dell'ordine di collegamento? Nel collegamento molecolare orbitale σ1s Abbiamo 2 elettroni; Mentre nell'orbitale molecolare anti -fuggio σ1s* non ne abbiamo. Pertanto, il calcolo sarebbe:
O.E = (2-0)/2
= 1
Essere o.E uguale a 1, significa che il collegamento che unisce i due atomi di idrogeno è semplice: H-H. Generalmente, se questo valore è uguale o maggiore di 1, si dice che la molecola esista ed è stabile.
Lui2
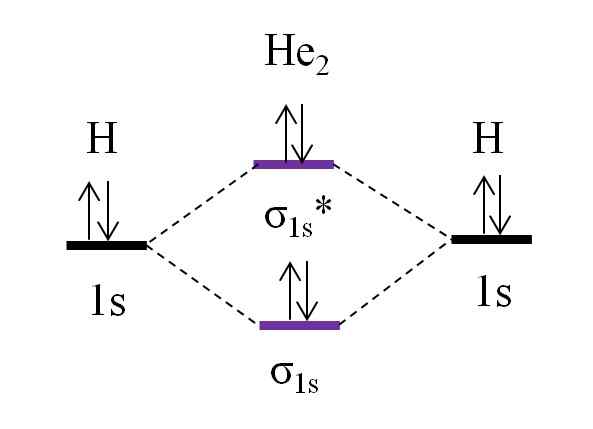 Diagramma OM per ipotetica molecola di dielio. Fonte: Gabriel Bolívar.
Diagramma OM per ipotetica molecola di dielio. Fonte: Gabriel Bolívar. Supponiamo ora che tu abbia la molecola di lui2. Sopra vediamo che il suo diagramma OM è molto simile a H2, Con 2 elettroni aggiuntivi che si trovano nell'orbitale σ1s*. Quando ci sono un totale di 4 elettroni che aggiungono i due atomi, allora ci devono essere anche 4 elettroni in tutti gli orbitali molecolari risultanti.
Determinare la o.E per l'i He2 avremo:
O.E = (2-2)/2
= 0
Ciò significa che non vi è alcun legame possibile che i due atomi di elio. In effetti, ad oggi l'esistenza di questa molecola non è stata identificata, il che concorda con le previsioni della teoria orbitale molecolare.
B2
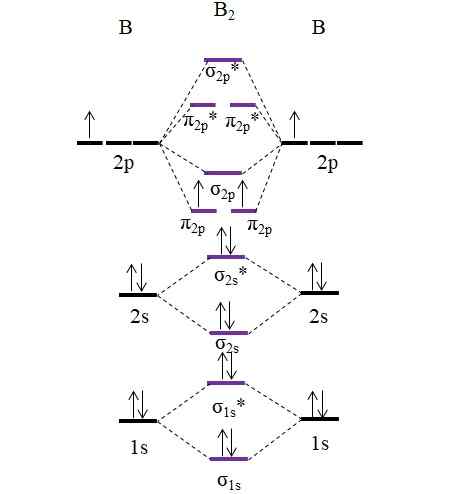 Diagramma OM per la molecola B2. Fonte: Gabriel Bolívar.
Diagramma OM per la molecola B2. Fonte: Gabriel Bolívar. Si noti che nella formazione di orbitali molecolari, gli elettroni degli strati interni sono anche presi in considerazione; Non solo quelli di Valencia.
Pertanto, nell'esempio della molecola Diboro, b2, Ogni atomo di boro contribuisce in totale 5 elettroni, 3 dei quali provengono da Valencia; Questi sono, quelli dei loro orbitali 2s e 2p. I due elettroni degli orbitali 2p sono posizionati in diversi orbitali molecolari π2 p Con spine parallele (regola del lavandino).
Procediamo quindi per calcolare l'ordine di collegamento:
O.E = (6-4)/2
= 1
Pertanto, la molecola dovrebbe avere un semplice collegamento B-B. Il b2 È una molecola che esiste solo nella fase del vapore a temperature molto elevate, perché il boro in condizioni normali adotta strutture e progetti di rete più complessi.
C2 e C22-
Considera prima il diagramma OM per la molecola C2:
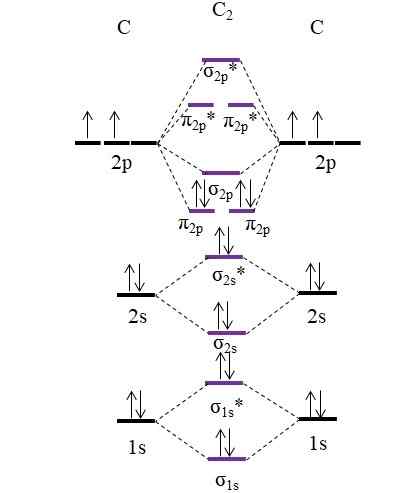 Diagramma OM per molecola C2. Fonte: Gabriel Bolívar.
Diagramma OM per molecola C2. Fonte: Gabriel Bolívar. Ora, i due nuovi elettroni forniti dagli atomi di carbonio sono di nuovo posizionati negli orbitali molecolari π2 p Ma con giri opposti (principio di esclusione pauling).
Determinare il tuo ordine di collegamento che avremo:
O.E = (8-4)/2
= 2
Si noti che orbitali molecolari π2 p Aggiungi 4 elettroni in legame alla formula. Essendo questo ordine uguale a 2, significa quella molecola C2 Ha un doppio legame, c = c. Ancora una volta, molecola C2, Chiamato anche carbonio diatomico, esiste solo una fase di vapore ad alte temperature ed è una delle forme allotropiche più semplici di carbonio.
E che dire di C22-? Il tuo diagramma OM è il seguente:
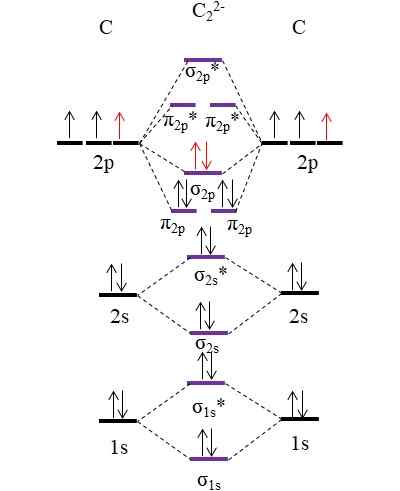 Diagramma OM per l'anione C22-. Fonte: Gabriel Bolívar.
Diagramma OM per l'anione C22-. Fonte: Gabriel Bolívar. I due nuovi elettroni (frecce rosse) sono posizionati nel collegamento orbitale molecolare σ2 p. Ciò suppone quindi che ogni atomo di carbonio contribuisca a una delle due cariche negative (per uno stato di ossidazione di -1).
Può servirti: Mercury Fulminate: Struttura, Proprietà, Ottenimento, UsiCalcolo del tuo ordine di collegamento che avremo:
O.E = (10-4)/2
= 3
Cioè, anione c22-, Chiamato anche anione acetiluro, ha un triplo collegamento, [Céc]2-. È un anione relativamente stabile con una grande forza di collegamento; Tuttavia, a seconda dei suoi ioni di controparte, può originare composti esplosivi.
N2 e n2+
La famosa molecola di azoto, n2, Può anche essere descritto perfettamente usando diagrammi orbitali molecolari:
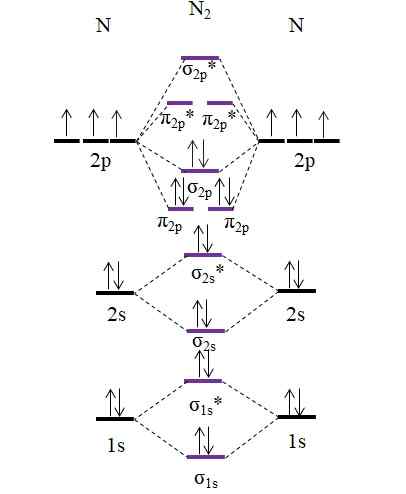 Diagramma OM per la molecola N2. Fonte: Gabriel Bolívar.
Diagramma OM per la molecola N2. Fonte: Gabriel Bolívar. Si noti che questo diagramma è esattamente lo stesso dell'anione C22-. Questo significa che n2 e C22- Sono isolectronici. Tuttavia, tale fatto non implica che entrambe le specie si comportino allo stesso modo. Poi2, neutro, è molto più stabile di c22-, negativo, anche se entrambi hanno un ordine di collegamento pari a 3, N /n.
E che dire del cation n2+? Diamo un'occhiata al tuo diagramma OM:
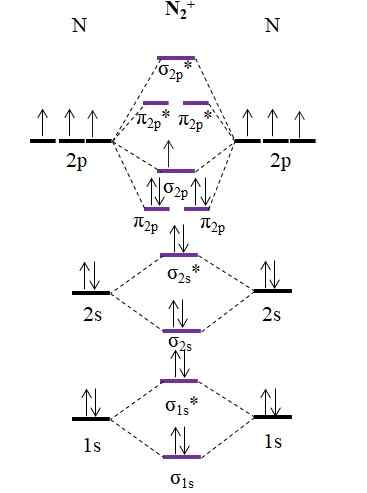 Diagramma OM per cation N2+. Fonte: Gabriel Bolívar.
Diagramma OM per cation N2+. Fonte: Gabriel Bolívar. Come il cation n2+ Ha un elettrone in meno, questo viene rimosso l'orbitale molecolare σ2 p. Poi2 È diamagnetico, mentre N2+ È paramagnetico. E il suo ordine di collegamento è:
O.E = (9-4)/2
= 2.5
Un link 2 2.5 sarebbe rappresentato con due righe e un punto. Tuttavia, una cosa del genere non ha molto senso nella teoria di Valencia o nelle strutture di Lewis. Poiché questo ordine di collegamento è inferiore a 3, la forza del collegamento presente nella n2+ è inferiore a n2, Quindi è più instabile.
O2, O22- IO22+
Vediamo ora un'altra molecola molto importante per la vita: ossigeno molecolare o diatomico, o2. Secondo la teoria di Valencia e le strutture di Lewis, dovrebbe essere diamagnetica; Ma sperimentalmente ha dimostrato di essere paramagnetico, quindi è scomparso da qualche parte.
Di seguito confrontiamo i diagrammi OM per la O2 e ioni o22- (ossido) e o22+ (Ossidicazione):
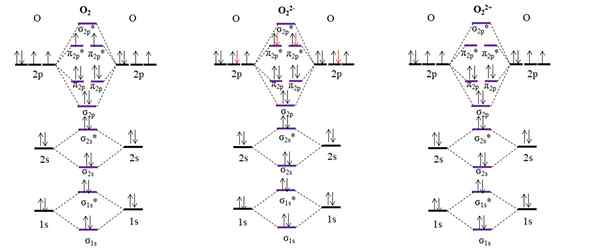 Diagrammi OM per ossigeno molecolare e due dei suoi ioni principali. Fonte: Gabriel Bolívar.
Diagrammi OM per ossigeno molecolare e due dei suoi ioni principali. Fonte: Gabriel Bolívar. Il diagramma OM per il O2 Campione, a differenza di quelli precedenti, che gli orbitali molecolari σ2 p e π2 p Cambia la loro posizione energetica. Inoltre, vediamo efficacemente che ci sono due elettroni mancanti negli orbitali π2 p*, che spiega il carattere paramagnetico dell'ossigeno (menzionato all'inizio dell'articolo).
D'altra parte, abbiamo anche il diagramma OM per l'anione o22-, Distribuito infinitamente nel cosmo (lune, pianeti, comete, asteroidi, ecc.). Ha due elettroni extra (frecce rosse), che finiscono di riempire gli orbitali π2 p*, Accoppiando tutti gli elettroni. Di conseguenza, il22- È diamagnetico.
Consideriamo anche il diagramma OM per l'ossidicazione o22+. Ha due elettroni in meno di O2, lasciando vuoti gli orbitali π2 p*. Tutti i suoi elettroni sono accoppiati, e quindi è diamagnetico.
Ordini di collegamento per O2, O22- IO22+ Sono, rispettivamente: 2 (O = O), 1 [O-O]2- e 3 [oosito]2+. Pertanto, il O22+ Avrebbe il collegamento più forte.
Vantaggi e svantaggi
Vantaggi
Tra i vantaggi della teoria orbitale molecolare possiamo citare quanto segue:
-Permette di valutare gli ordini di collegamento che l'ordinario non avrebbe molto senso nella teoria dei collegamenti di Valencia
-Si correla bene con il diamagnetismo e il paramagnetismo delle molecole
-La distanza che separa gli orbitali molecolari nei diagrammi è uguale a ΔE e serve a spiegare il prodotto delle transizioni elettroniche dell'assorbimento dei fotoni
-Si applica non solo per le molecole diatomiche omonucleari, ma anche per le molecole eteronucleari, come CO2 e benzene
-Estende il suo modello verso altri tipi di composti, come i complessi inorganici, quindi supporta la teoria del campo dei ligandi
-La considerazione che gli elettroni siano trasferiti in tutta la molecola è conveniente per spiegare molte delle proprietà fisico
Svantaggi
E tra alcuni degli svantaggi della teoria orbitale molecolare che abbiamo, per finire:
-È molto astratto e richiede una profonda comprensione matematica per comprenderlo appieno
-Diagrammi di molecolazione come CO2, CO, h2O e altri, possono essere troppo noiosi per elaborare e spiegare
-Non dice nulla su regioni specifiche o collegamenti di una grande molecola
-Né fornisce informazioni sulla geometria molecolare (piano trigonale, piano quadrato, tetraedrico, ecc.).
-Non è grafico come la teoria dei collegamenti di Valencia
La teoria orbitale molecolare, in conclusione, è una teoria che completa la teoria del legame di Valencia per avere un panorama più ampio e completo dello spettro molecolare.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Teoria molecolare orbitale. Recuperato da: in.Wikipedia.org
- Stephen inferiore. (7 settembre 2020). Teoria molecolare orbitale. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Steven a. Hardinger. (2017). Teoria molecolare orbitale. Estratto da: Cheded.Chimica.Purdue.Edu
- Pressbook. (S.F.). Capitolo 8: Teoria molecolare orbitale. Estratto da: OpenTextbc.AC

