Storia della teoria cinetica molecolare, postula ed esempi

- 4806
- 967
- Zelida Gatti
IL Teoria cinetica molecolare È uno che cerca di spiegare le osservazioni sperimentali dei gas da una prospettiva microscopica. Cioè, cerca di associare la natura e il comportamento delle particelle gassose, alle caratteristiche fisiche del gas come fluido; Spiega il macroscopico dal microscopico.
I gas sono sempre stati oggetto di interesse per gli scienziati a causa delle loro proprietà. Occupano l'intero volume del contenitore in cui sono, essendo in grado di comprimere completamente senza il loro contenuto che si oppone alla resistenza inferiore; E se la temperatura aumenta, il contenitore inizia ad espandersi e può persino rompere.
 Particelle gassose in condizioni distanti o vicine alla liquefazione. Fonte: Olivier Cleynen e Utente: Sharayanan [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Particelle gassose in condizioni distanti o vicine alla liquefazione. Fonte: Olivier Cleynen e Utente: Sharayanan [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Molte di queste proprietà e comportamenti sono riassunti nelle leggi dei gas ideali. Tuttavia, considerano il gas nel suo insieme e non come un insieme di milioni di particelle disperse nello spazio; Inoltre, non fornisce, dai dati di pressione, volume e temperatura, ulteriori informazioni su come si muovono queste particelle.
È così che la teoria cinetica molecolare (TCM), propone di visualizzarli come sfere mobili (immagine superiore). Queste sfere si scontrano tra loro e le pareti arbitrariamente e mantengono una traiettoria lineare. Tuttavia, quando la temperatura diminuisce e la pressione aumenta, la traiettoria delle sfere diventa curva.
Un gas, secondo il TCM, deve comportarsi come le sfere della prima scatola dell'immagine. Ma, quando si è raffreddato e aumenta la pressione su di loro, il loro comportamento si allontana dall'ideale. Sono quindi gas reali, vicini alla liquefazione e vanno in fase liquida.
In queste condizioni, le interazioni tra le sfere diventano più importanti, al punto che le loro velocità momentaneamente rallentano. Più si avvicinano dalla liquefazione, più curve diventano le loro traiettorie (scatola a destra) e le loro collisioni sono meno energia.
[TOC]
Storia
Daniel Bernoulli
L'idea di queste sfere, meglio chiamate atomi, era già stata considerata dal filosofo romano Lucrezio; Non per gas, ma per oggetti solidi e statici. D'altra parte, nel 1738 Daniel Bernoulli applicò la visione atomica a gas e liquidi immaginandoli come sfere disordinate che si muovono in tutte le direzioni.
Il suo lavoro, tuttavia, violava le leggi della fisica in quel momento; Un corpo non poteva muoversi per sempre, quindi era impossibile pensare che un insieme di atomi e molecole si scontrasse tra loro senza perdita della loro energia; cioè, l'esistenza di collisioni elastiche non era possibile.
Rudolf Clausius
Un secolo dopo, altri autori rafforzarono il TCM con un modello in cui le particelle gassose si muovevano in una direzione. Rudolf Clausius, tuttavia, ha compilato i suoi risultati e ha armato un modello più completo del TCM con cui ha cercato di spiegare le leggi ideali di gassa dimostrate da Boyle, Charles, Dalton e Avogadro.
Può servirti: coulombimetria: fondamentali, tipi, applicazioniJames Clerk Maxwell e Ludwig Boltzmann
Nel 1859, James Clerk Maxwell dichiarò che le particelle gassose presentano una gamma di velocità a una data temperatura e che un insieme di esse può essere considerato per mezzo di una velocità molecolare media.
Quindi, nel 1871 Ludwig Boltzmann collegava idee esistenti con entropia e come termodinamicamente tende sempre ad occupare lo spazio massimo possibile in modo omogeneo e spontaneo.
Postulare la teoria cinetica molecolare
Considerare il gas dalle sue particelle, un modello in cui sono soddisfatti determinati postulati o ipotesi; postulato che logicamente dovrebbe essere in grado di prevedere e spiegare (il più fedele possibile) le osservazioni macroscopiche e sperimentali. Detto questo, i postulati del TCM sono menzionati e descritti.
Il volume delle particelle gassose è trascurabile
In un contenitore pieno di particelle gassose, si disperdono e si allontanano tra loro attraverso tutti gli angoli. Se per un momento potessero incontrarsi tutti in un punto specifico del contenitore, senza liquefazione, si osserva che occupano a malapena una parte spregevole del volume del contenitore.
Significa che nel contenitore, anche se contiene milioni di particelle gassose, è davvero più vuoto del pieno (rapporto volume-vacío molto meno di 1); Pertanto, se le sue barriere lo permettono, lui e il gas all'interno possono essere compressi bruscamente; Dal momento che le particelle sono molto piccole, proprio come il loro volume.
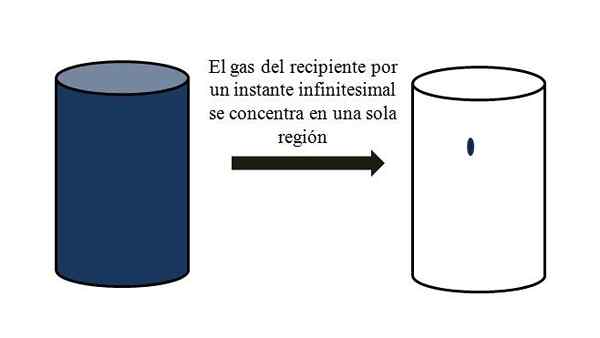 Volume-Vacío Relazione di un gas in un contenitore. Fonte: Gabriel Bolívar.
Volume-Vacío Relazione di un gas in un contenitore. Fonte: Gabriel Bolívar. L'immagine superiore illustra con precisione ciò che viene commentato sopra, usando un gas bluastro.
Le forze di attrazione tra le particelle sono nulle
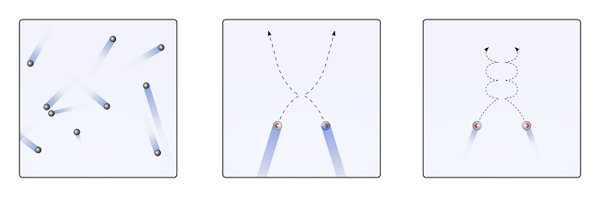
Particelle gassose all'interno del contenitore si scontrano tra loro senza tempo sufficiente affinché le loro interazioni diventino forza; Ancora meno quando ciò che li circonda principalmente è vuoto molecolare. Una conseguenza immediata di ciò è che le loro traiettorie lineari consentono loro di coprire completamente il volume del contenitore.
Se quanto sopra non fosse così, un contenitore "bizzarro" e "labirintico" avrebbe regioni bagnate a causa della condensa del gas; Invece, le particelle viaggiano l'intero contenitore con piena libertà, senza la forza delle loro interazioni fermandole.
Può servirti: acido clorico (HCLO3) Esprimere le particelle gassose quando le interazioni sono nulle o insignificanti (a., lineare) e quando sono importanti (b., curve). Fonte: Gabriel Bolívar.
Esprimere le particelle gassose quando le interazioni sono nulle o insignificanti (a., lineare) e quando sono importanti (b., curve). Fonte: Gabriel Bolívar. Le traiettorie lineari dell'immagine superiore (a.) dimostra questo postulato; Mentre se le traiettorie sono curve (b.), prove che ci sono interazioni che non possono essere ignorate tra le particelle.
Le particelle gassose sono sempre in movimento
Dai primi due postulati convergono inoltre il fatto che le particelle di gas non smetta mai di muoversi. Una volta sfocati nel contenitore, si scontrano tra loro e con le pareti dello stesso, con una forza e una velocità direttamente proporzionali alla temperatura assoluta; Questa forza è, la pressione.
Se le particelle gassose smettono di muoversi un momento, verrebbero assistite all'interno delle "lingue di fumo", derivanti dal nulla, con abbastanza tempo per ordinarci nel vuoto e dare modi casuali.
Le collisioni tra le particelle e le pareti del contenitore sono elastiche
Se le collisioni elastiche tra le particelle gassose e le pareti del contenitore non si verificheranno mai all'interno del contenitore, non si verificheranno mai (mentre le condizioni fisiche non cambiano) la condensa del gas; o cosa è lo stesso di dire che non si riposano mai e si scontrano sempre.
Questo perché nelle collisioni elastiche non vi è alcuna perdita netta di energia cinetica; Una particella si scontra con il muro e rimbalza alla stessa velocità. Se una particella quando la collisione riduce la velocità, l'altra accelera, senza calore o suono che dissipa l'energia cinetica di nessuno di essi.
L'energia cinetica non rimane costante
Il movimento delle particelle è casuale e caotico, in modo che non tutti portino la stessa velocità; Come succede, ad esempio, su un'autostrada o in mezzo alla folla. Alcuni sono più energici e viaggiano più velocità, mentre altri sono lenti, aspettando che una collisione li accelera.
Per descrivere la tua velocità, è quindi necessario calcolare una media; E con questo, si ottiene l'energia cinetica media delle particelle o delle molecole di gas. Poiché l'energia cinetica di tutte le particelle cambia in modo costante, la media consente un migliore controllo dei dati e puoi funzionare con una maggiore affidabilità.
L'energia cinetica media è uguale a una data temperatura per tutti i gas
Energia cinetica molecolare media (ECMp) In un contenitore viene modificato con la temperatura. A una temperatura più elevata, questa energia sarà maggiore. Poiché è una media, potrebbero esserci particelle o soda che hanno un'energia maggiore o minore rispetto a questo valore; un po 'più veloce e più lento, rispettivamente.
Può servirti: acidi e basi: differenze, caratteristiche, esempiMatematicamente si può dimostrare che ECMp Dipende esclusivamente dalla temperatura. Ciò significa che non importa cosa il gas, la sua massa molecolare o la struttura, la sua ECMp Sarà lo stesso a temperatura t e varierà solo se aumenta o diminuisce. Di tutti i postulati forse questo è il più rilevante.
E per quanto riguarda la velocità molecolare media? A differenza di ECMp, La massa molecolare influenza la velocità. Più pesante è la particella o la molecola di gas, è naturale aspettarsi di muoversi più lentamente.
Esempi
Di seguito sono riportati alcuni brevi esempi di come TCM è riuscito a dare spiegazioni alle leggi dei gas ideali. Sebbene non siano affrontati, altri fenomeni, come la diffusione e l'effusione dei gas, possono anche essere spiegati con il TCM.
Boyle Law
Se il volume del contenitore viene compresso a temperatura costante, la distanza che le particelle gassose devono scontrarsi per scontrarsi contro le pareti diminuisce; che è uguale ad un aumento della frequenza di queste collisioni, con conseguente maggiore pressione. Quando la temperatura è costante, ECMp È anche costante.
Charles Law
Se t, EC aumentaMp crescerà. Le particelle gassose si muoveranno più velocemente e si scontreranno un numero maggiore di volte con le pareti del contenitore; aumenta la pressione.
Se le pareti sono flessibili, in grado di espandersi, la sua area diventerà più grande e la pressione cadrà fino a quando non diventerà costante; E di conseguenza, il volume aumenterà anche.
La legge di Dalton
Se si aggiungessero diversi litri di gas diversi in un ampio contenitore, da contenitori più piccoli, la loro pressione interna totale sarebbe uguale alla somma delle pressioni parziali esercitate da ciascun tipo di gas separatamente.
Perché? Perché tutti i gas iniziano a scontrarsi tra loro e disperdersi omogenei; Le interazioni tra loro sono vuote e il vuoto predomina nel contenitore (postulati del TCM), quindi è come se ogni gas fosse trovato da solo, esercitando la sua pressione in modo individuale senza l'interferenza degli altri gas.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Cengage Learning, P 426-431.
- Fernández Pablo. (2019). Teoria cinetica molecolare. Vix. Recuperato da: VIX.com
- Jones, Andrew Zimmerman. (7 febbraio 2019). Teoria molecolare cinetica dei gas. Recuperato da: Thoughtco.com
- Hall Nancy. (5 maggio 2015). Teoria cinetica dei gas. Glenn Research Center. Estratto da: GRC.vaso.Gov
- Blaber m. & Inferiore s. (9 ottobre 2018). Nozioni di base sulla teoria molecolare cinetica. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- La teoria molecolare cinetica. Estratto da: Cheded.Chimica.Purdue.Edu
- Wikipedia. (2019). Teoria cinetica dei gas. Recuperato da: in.Wikipedia.org
- Toppr. (S.F.). Teoria molecolare cinetica dei gas. Recuperato da: toppr.com

