Effetti di sostituzione nucleofila aromatica, esempi
- 2896
- 881
- Ruth Cattaneo
IL Sostituzione nucleofila aromatica (SNAR) è una reazione che si verifica nella chimica organica, che consiste nello spostamento di un buon gruppo in uscita da parte di un nucleofilo in arrivo. Dal punto di vista del suo meccanismo e degli aspetti elettronici, è la faccia opposta della sostituzione elettrofila aromatica (SEAR).
Generalmente il gruppo in uscita è un alogeno, che viene fuori come anione di Haluro-. Questa reazione può avvenire solo se l'anello aromatico (principalmente benzene) è carente di elettroni; Cioè, se hai gruppi di sostituenti per attrattori di elettroni.
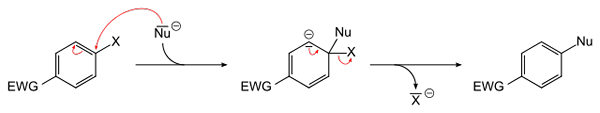
 Equazione generale per una sostituzione nucleofila aromatica. Fonte: sponk [dominio pubblico]
Equazione generale per una sostituzione nucleofila aromatica. Fonte: sponk [dominio pubblico] L'immagine superiore schematizza ciò che è stato detto nel paragrafo precedente. Il gruppo EWG Electron Attractor (per il suo acronimo in inglese: Gruppo di prelievo di elettroni), attiva l'anello aromatico per l'attacco nucleofilo delle specie negative di Nu-. Si può vedere che si forma un intermediario (al centro), da cui viene rilasciato o rilasciato l'Haluro X-.
Si noti che in semplici termini X è sostituito da Nu in un anello aromatico. Questa reazione è molto versatile e necessaria nella sintesi di nuovi farmaci, nonché negli studi sulla chimica organica sintetica.
[TOC]
Caratteristiche generali
L'anello aromatico può essere "caricato" o "download" da elettroni a seconda di quali sono i loro sostituenti (quelli che sostituiscono il collegamento C-H originale).
Quando questi sostituenti possono donare la densità elettronica sul ring, si dice che lo arricchiscono dagli elettroni; Se al contrario sono attrattori di densità elettronica (l'EWG menzionato sopra), si dice che impoverono l'anello elettronico.
In ogni caso, l'anello viene attivato per una reazione aromatica specifica, mentre è disattivato per l'altro.
Ad esempio, si dice che un anello aromatico ricco di elettroni sia attivo per la sostituzione elettrofila aromatica; Cioè, puoi donare i tuoi elettroni a una specie di elettrofilato e+. Tuttavia, non donerà elettroni a una specie Nu-, Poiché le spese negative si respingono a vicenda.
Può servirti: teoria orbitale molecolareOra, se l'anello è scarso negli elettroni, non ha come darli alla specie e+ (Sear non si verifica); Invece, è disponibilità accettare gli elettroni della specie Nu- (SNAR si sviluppa).
Differenze con la sostituzione elettrofila aromatica
Chiarisce gli aspetti generali dell'ingresso, ora possono essere elencate alcune differenze tra SNAR e Sear:
- L'anello aromatico funge da elettrofilo (elettroni poveri) ed è attaccato da un nucleofilo.
- Un gruppo X in uscita viene sostituito dall'anello; Non un h+
- Non si formano carbocazioni, ma intermediari con una carica negativa che può essere trasferita dalla risonanza
- La presenza di gruppi più attraenti nel ring accelera la sostituzione invece di rallentarla
- Infine, questi gruppi non esercitano direttori su dove (in cui carbonio) si verificherà la sostituzione. La sostituzione si verificherà sempre in carbonio collegato al gruppo in uscita X.
L'ultimo punto è anche illustrato nell'immagine: il collegamento C-X è rotto per formare il nuovo collegamento C-NU.
Effetti
Del numero di sostituenti
Naturalmente, più povero negli elettroni è l'anello, più velocemente lo Snar e il meno drastico saranno le condizioni necessarie affinché si verifichino. Considera il seguente esempio rappresentato nell'immagine inferiore:
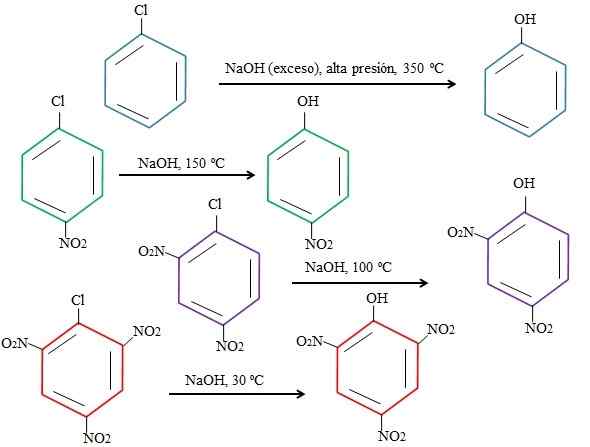 Effetti dei sostituenti sulle sostituzioni di 4-nitroclorobenzene. Fonte: Gabriel Bolívar.
Effetti dei sostituenti sulle sostituzioni di 4-nitroclorobenzene. Fonte: Gabriel Bolívar. Si noti che il 4-nitroclorobenzene (anello blu) richiede condizioni drastiche (alta pressione e una temperatura di 350 ºC) alla sostituzione del CL con. In questo caso, il cloro è il gruppo in uscita (CL-) e l'idrossido nucleofilo (OH-).
Può servirti: 4 periodi di chimica: dalla preistoria fino ad oggiQuando il gruppo non appare2, che è un attrattore di elettroni (anello verde), la sostituzione può essere effettuata a una temperatura di 150 ºC a pressione ambientale. Man mano che il numero di gruppi aumenta no2 Presente (anelli viola e rossi), la sostituzione avviene a temperature sempre più basse (rispettivamente 100 ºC e 30 ° C).
Pertanto, i gruppi no2 Accelerano il Snar e l'impotilla dagli elettroni all'anello, rendendolo più suscettibile all'attacco di OH-.
Le posizioni relative del CL non saranno spiegate qui rispetto a no2 nel 4-nitroclorobenzene e come alterano la velocità della reazione; Ad esempio, le velocità di reazione del 2-nitroclorobenzene e del 3-nitroclorobenzene sono diverse, quest'ultima è la più lenta rispetto agli altri isomeri.
Del gruppo in uscita
Tornando al 4-nitroclorobenzene, la sua reazione di sostituzione è più lenta se si confronta quella della controparte fluorata:
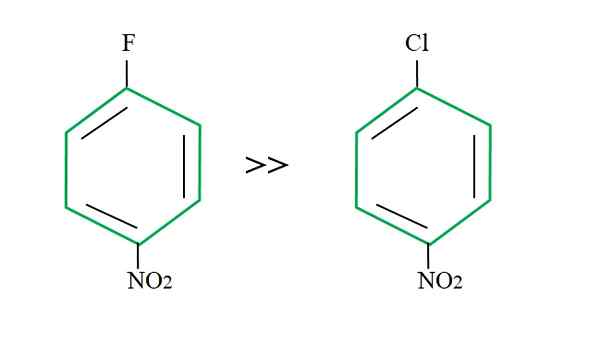 Effetto di gruppo in uscita sulle reazioni SNAR. Fonte: Gabriel Bolívar.
Effetto di gruppo in uscita sulle reazioni SNAR. Fonte: Gabriel Bolívar. La spiegazione di questo non può risiedere in un'altra variabile che la differenza tra f e cl. Il fluoro è un gruppo in uscita scadente, perché il collegamento C-F è più difficile da rompere rispetto al collegamento C-CL. Pertanto, la rottura di questo collegamento non è la fase determinante della velocità per lo SNAR, ma l'aggiunta della NU- sull'anello aromatico.
Il fluoro per essere più elettronegativo del cloro, l'atomo di carbonio collegato ad esso ha una maggiore carenza elettronica (cΔ+-FΔ-). Di conseguenza, è molto più probabile che il carbonio del collegamento C-F venga attaccato da Nu- rispetto al collegamento C-CL. Ecco perché la sostituzione di F di OH è molto più veloce di quella di CL di OH.
Può servirti: solfuro di rame: struttura, proprietà, usiEsempio
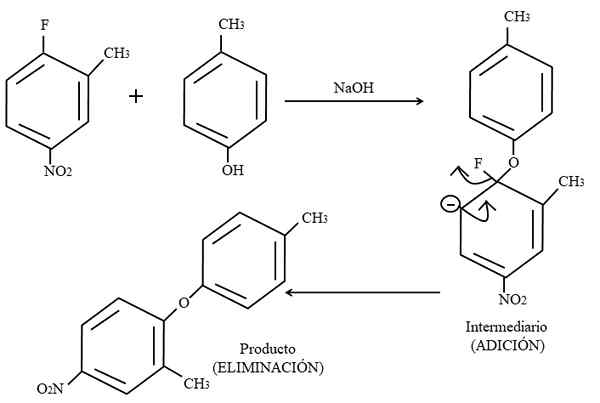 Sostituzione elettrofila aromatica. Fonte: Gabriel Bolívar.
Sostituzione elettrofila aromatica. Fonte: Gabriel Bolívar. Infine, un esempio di questo tipo di reazioni organiche nell'immagine superiore è mostrato di seguito. Para-coreresol non dà la comparsa di essere un nucleofilo; Ma avendo un mezzo di base, il suo gruppo OH non è protetto, lasciando un anione di fenossido, che attacca il 2-metil-4-nitrofluorzene.
Quando si verifica questo attacco, si dice che il nucleofilo venga aggiunto all'elettrofilo. Questo passaggio può essere visto a destra dell'immagine, in cui si forma il composto intermedio con entrambi i sostituenti appartenenti all'anello.
Aggiungendo il para-coresol, appare un carico negativo che trasferisce la risonanza all'interno dell'anello (notare che cessa di essere aromatico).
Nell'immagine, l'ultima struttura di risonanza è appena mostrata, da cui il fluoruro è finito come F-; Ma in realtà questo carico negativo diventa disoccupio anche negli atomi di ossigeno del gruppo2. Dopo l'aggiunta dell'eliminazione, l'ultima, che è quando il prodotto viene finalmente formato.
Commento finale
Il gruppo n2 Rimanere può essere ridotto al gruppo NH2, E da lì è possibile fare più reazioni di sintesi per modificare la molecola finale. Ciò dimostra il potenziale sintetico dello SNAR e che il suo meccanismo, inoltre, consiste in due passaggi: uno di aggiunta e quello di eliminazione.
Attualmente, tuttavia, ci sono prove sperimentali e computazionali che in realtà la reazione procede seguendo un meccanismo concertato, in cui entrambi i passaggi si verificano simultaneamente attraverso un complesso attivato e non un intermediario.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- Wikipedia. (2019). Sostituzione aromatica nucleofila. Recuperato da: in.Wikipedia.org
- James Ashenhurst. (6 settembre 2019). Sostituzione aromatica nucleofila (NAS). Recuperato da: MasterOrganicChemistry.com
- Chimica librettexts. (5 giugno 2019). Sostituzione aromatica nucleofila. Recuperato da: Chem.Librettexts.org

