Zinco solfuro (ZNS)
- 4116
- 1100
- Ruth Cattaneo
 Zinco solfuro. Fonte: Wikimedia Commons
Zinco solfuro. Fonte: Wikimedia Commons Cos'è il solfuro di zinco?
Lui Zinco solfuro È un composto inorganico di formula zNS, formato da cationi Zn2+ e anioni s2-. Si trova in natura principalmente come due minerali: la Wurtzite e la Sfeny (o Blenda di zinco), quest'ultima è la sua forma principale.
Lo sfenhell è presentato nella natura nera a causa delle impurità che presenta. Presenta puramente cristalli bianchi, mentre la Wurtzita ha cristalli bianchi grigiastri.
Il solfuro di zinco è insolubile in acqua. Può causare danni ambientali, poiché penetra nel terreno e contamina le acque sotterranee e le loro correnti.
Il solfuro di zinco può verificarsi, tra le altre reazioni, corrosione e neutralizzazione.
Di corrosione:
Zn +H2S => Zns +H2
Per neutralizzazione:
H2S +Zn (OH)2 => Zns +2H2O
Il solfuro di zinco è un sale fosforescente, il che gli dà la capacità di più usi e applicazioni. Inoltre, è un semiconduttore e una fotocatizzazione.
Struttura del solfuro di zinco
Il solfuro di zinco adotta strutture cristalline governate da attrazioni elettrostatiche tra il catione Zn2+ e anione s2-. Questi sono due: la sfenità o lo zinco blenda e la wurzita. In entrambi gli ioni minimizzano le repulsioni tra ioni uguali.
Lo zinco blenda è la più stabile in condizioni terrestri di pressione e temperatura; E la Wurzita, che è meno densa, deriva dalla riorganizzazione cristallina a causa dell'aumento della temperatura.
Le due strutture possono coesistere nello stesso solido Zn allo stesso tempo, sebbene, molto lentamente, la Wurzita finirà prevalentemente.
Zinco blenda
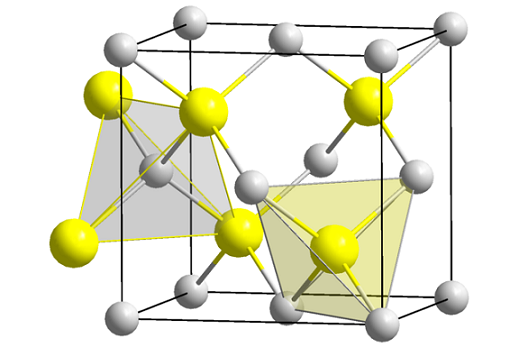
 Struttura di Blenda di zinco (Sfeny). Fonte: Wikimedia Commons
Struttura di Blenda di zinco (Sfeny). Fonte: Wikimedia Commons L'immagine superiore mostra la cellula cubica centrata sui volti della struttura della blenda di zinco. Le sfere gialle corrispondono agli anioni2-, e grigio a cationi Zn2+, Situato negli angoli e nei centri delle facce del cubo.
Può servirti: isobutil: nomenclatura, formazione, struttura e caratteristicheNota le geometrie tetraedriche attorno agli ioni. Lo zinco blenda può anche essere rappresentato da questi tetraedri, i cui fori all'interno del vetro hanno la stessa geometria (cavità tetraedriche).
Inoltre, la proporzione ZNS è soddisfatta all'interno delle celle unitarie; cioè una proporzione 1: 1. Pertanto, per ogni catione Zn2+ C'è un anione s2-. Nell'immagine può sembrare che le sfere grigie abbondano, ma in realtà quando sono negli angoli e al centro delle facce del mozzo sono condivise da altre cellule.
Ad esempio, se vengono prese le quattro sfere gialle che si trovano all'interno della scatola, i "pezzi" di tutte le sfere grigie in circolazione dovrebbero aggiungere lo stesso (e farlo), quattro. Quindi, nella cellula unitaria cubica ci sono quattro Zn2+ e quattro s2-, La proporzione stechiometrica Zns è soddisfatta.
Allo stesso modo, è importante sottolineare che ci sono fori tetraedrici in avanti e dietro le sfere gialle (lo spazio che le separa l'una dall'altra).
Wurzita
 Struttura di Wurzite. Fonte: Wikimedia Commons
Struttura di Wurzite. Fonte: Wikimedia Commons A differenza della struttura della Blenda di zinco, la Wurzita adotta un sistema cristallino esagonale (immagine superiore). Questo è meno compatto, quindi il solido ha meno densità.
Gli ioni in Wurzita hanno anche ambienti tetraedrici e una proporzione 1: 1 che concorda con la formula ZNS.
Proprietà del solfuro di zinco
Colore
Può essere presentato in tre modi:
-La Wurtzita, di cristalli bianchi ed esagonali.
-Lo sfenhell, di cristalli bianchi-arricani e cristalli cubici.
-Come una polvere bianca da bianco a grigiastro o giallastro e cristalli cubi giallastri.
Punto di fusione
1.700 ° C.
Solubilità dell'acqua
Praticamente insolubile (0,00069 g/100 ml a 18 ° C).
Solubilità
Insolubile in alcali, solubile in acidi minerali diluiti.
Densità
Sfere 4,04 g/cm3 e Wurtzita 4.09 g/cm3.
Durezza
Ha una durezza da 3 a 4 sulla scala MOHS.
Stabilità
Quando si contiene acqua ossida lentamente il solfato. In un ambiente secco è stabile.
Decomposizione
Se riscaldato ad alte temperature, emette vapori tossici di zinco e ossidi solforosi.
Può servirti: idruro di sodio (NAH): proprietà, reattività, pericoli, usiNomenclatura del solfuro di zinco
La configurazione elettronica di Zn è [AR] 3D104s2. Quando si perdono i due elettroni dell'orbitale 4S è come il catione Zn2+ Con i suoi orbitali di pieno. Pertanto, dal momento che elettronicamente lo Zn2+ È molto più stabile di Zn+, Ha solo una valenza di +2.
Quindi, è omesso per la nomenclatura delle scorte, aggiungendo la sua valenza racchiusa tra parentesi e con numero romano: solfuro di zinco (II).
Nomenclature sistematiche e tradizionali
Ma ci sono altri modi per chiamare Zns oltre a quello già sollevato. Nel sistematico, il numero di atomi di ciascun elemento è specificato con i numeratori greci, con l'unica eccezione dell'elemento a destra quando è solo uno. Pertanto, gli ZN sono nominati come: paninozinco solfuro (e non monozinc monosulfuro).
Per quanto riguarda la nomenclatura tradizionale, allo zinco quando si ha una singola valenza di +2, viene aggiunta aggiungendo il suffisso -co. Di conseguenza, il suo nome tradizionale è: zínc solfuroICO.
Usi di solfuro di zinco
Come pigmenti o rivestimenti
Sachtolith
Il sachtholith è un pigmento bianco realizzato con solfuro di zinco. È usato in putties, mastiques, sigillanti, coperture inferiori, vernici in lattice e segnaletica.
Il suo uso combinato con pigmenti assorbenti di luce ultravioletta, come micro titanio o pigmenti di ossido di ferro trasparente, è necessario nei pigmenti resistenti alle intemperie.
Zns e dipinti in lattice
Quando gli ZN vengono applicati in dipinti in lattice o strutturati, ha prolungato un'azione del microbicida.
Frame di finestre e aeromobili
A causa della sua grande durezza e resistenza a rottura, erosione, pioggia o polvere, lo rende adatto alle finestre a infrarossi esterni o nei telai degli aeromobili.
Rivestimento e altri usi
Gli Zn vengono utilizzati nel rivestimento dei rotori utilizzati nel trasporto di composti, per ridurre l'usura. Inoltre, viene utilizzato nella produzione di inchiostri di stampa, composti isolanti, pigmentazione termoplastica, materie plastiche resistenti alle fiamme e lampade elettroluminescenti.
Può servirti: tunsen più leggero: caratteristiche, funzioni, esempi di utilizzoDispositivi e schermi della visione notturna
-Il solfuro di zinco può essere trasparente, essendo in grado di essere usato come finestra per l'ottica visibile e l'ottica a infrarossi. Viene utilizzato nei dispositivi di visione notturna, su schermi televisivi, schermi radar e rivestimenti fluorescenti.
Elettroluminescenza
Il doping Zns con Cu viene utilizzato nella produzione di pannelli di elettroluminescenza. Inoltre, viene utilizzato nella propulsione a razzo e nella gravimetria.
Per la sua fosforescenza
La sua fosforescenza viene utilizzata per tingere gli aghi dell'orologio e quindi visualizzare il tempo al buio; Anche nei dipinti per giocattoli, segnali di emergenza e avvisi di traffico.
La fosforescenza consente l'uso del solfuro di zinco nei tubi dei raggi catodici e sugli schermi raggi X per brillare in punti scuri. Il colore della fosforescenza dipende dall'attivatore utilizzato.
Semiconduttore, fotocatizzazione e catalizzatore
- La sfenità e la wurtzite sono semiconduttori a banda larga. La sfalerite ha una fessura da 3,54 eV, mentre la Wurtzita ha un bit da 3,91 eV -band.
- Lo Zns viene utilizzato nella preparazione di un fotocatalizzatore composto da CDS - Zns/zirconio - titanio fosfato, utilizzato per la produzione di idrogeno sotto luce visibile.
- Interviene come catalizzatore per il degrado degli inquinanti organici. È usato nella preparazione di un sincronizzatore a colori nelle lampade a LED.
- I suoi nanocristalli sono usati per il rilevamento delle proteine ultrasprensibili. Ad esempio, emettendo punti quantici di Zns. Viene utilizzato nella preparazione di un fotocatalizzatore combinato (CDS/Zns) -Tio2 per la produzione elettrica tramite fotoelettrocatalisi.
Riferimenti
- PUBCHEM (2018). Zinco solfuro. Preso da: pubchem.NCBI.Nlm.NIH.Gov
- Quiminet (16 gennaio 2015). Pigmento bianco a base di zinco solfuro. Recuperato da: quiminet.com
- Wikipedia (2018). Zinco solfuro. Preso da: in.Wikipedia.org
- II-VI UK (2015). Zinco solfuro (ZNS). Preso da: ii-vi.È
- Rob Toreki (30 marzo 2015). La struttura zincblende (Zns). Preso da: ilpi.com
- Chimica librettexts (22 gennaio 2017). Structure-Zinc Blende (ZNS). Tratto da: Chem.Librettexts.org
- Reade (2018). Solfuro solfuro/ zinco (ZNS). Tratto da: leggi.com

