Struttura del solfuro di calcio (CAS), proprietà, ottenimento, usi
- 4247
- 589
- Dante Morelli
Lui Solfuro di calcio È un solido inorganico formato dall'elemento di calcio (Ca) e dagli elementi dello zolfo, della formula chimica è CAS. È un solido solubile bianco giallastro in acqua, che si trova in natura in alcuni vulcani e in alcuni meteoriti sotto forma di un minerale chiamato oldhamite.
Il CAS quando si dissolve in acqua forma vari composti perché lo zolfo s2- diventa ione sh- E si sono formati ioni oh-. La soluzione risultante è alcalina. Questo composto viene usato come base per composti luminescenti o che producono luce visibile in determinate condizioni. Questi materiali sono utilizzati anche nei dipinti di luce.
 Il solfuro di calcio CAS è stato trovato in alcuni meteoriti. Autore: рote жравё ё. Fonte: Pixabay.
Il solfuro di calcio CAS è stato trovato in alcuni meteoriti. Autore: рote жравё ё. Fonte: Pixabay. Il CAS è stato considerato la possibile medicina per trattare problemi cardiaci e vasi sanguigni come ipertensione o alta pressione, che è una malattia che colpisce gran parte della popolazione mondiale.
Con solfuro di calcio è possibile ottenere altri composti come il nitrato di calcio e il carbonato di calcio. Deve essere gestito con cautela e in contatto con l'umidità dell'atmosfera può produrre h2S che è molto tossico.
[TOC]
Struttura
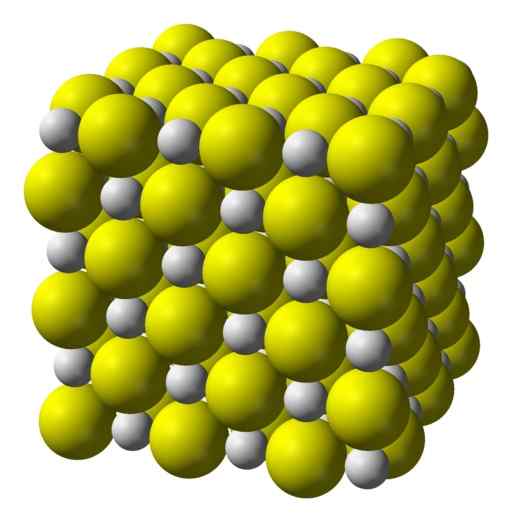
Il solfuro di calcio è un composto altamente ionico formato da uno ione di calcio CA2+ e uno ione solfuro s2-.
Cristallizza in una struttura cubica come il sale di roccia.
 Struttura cristallina cubica di solfuro di calcio. Giallo = zolfo; Bianco = calcio. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons.
Struttura cristallina cubica di solfuro di calcio. Giallo = zolfo; Bianco = calcio. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons. Nomenclatura
- Solfuro di calcio
Proprietà fisiche
Stato fisico
Cristalli cubici, solido cristallino bianco giallastro come cloruro di sodio.
Peso molecolare
72.144 g/mol
Punto di fusione
2528 ºC
Densità
2,59 g/cm3
Solubilità
Solubile in acqua. Insolubile in etanolo.
Proprietà chimiche
Soluzione acquosa
Quando si dissolve in acqua, il CAS viene separato nei suoi ioni di calcio 2+ e solfuro s2-. Quest'ultimo in acqua prende un protone e diventa lo ione idrosulfuro shh- rilasciando uno ione idrossile OH-.
Può servirti: setacciatoS2- + H2O ⇔ sh- + OH-
Pertanto, le soluzioni di solfuro di calcio sono alcaline (hanno pH di base) e non hanno ioni2- Ma sh-.
Solo nel caso in cui una grande quantità di alcali venga aggiunta alla soluzione come l'idrossido di naoh sodio. L'equilibrio si sposta verso la formazione di ioni di zolfo S2-.
 Il solfuro di calcio si dissolve in acqua che formano altri composti. Autore: clker-free-vector-images. Fonte: Pixabay.
Il solfuro di calcio si dissolve in acqua che formano altri composti. Autore: clker-free-vector-images. Fonte: Pixabay. The Sh- Puoi prendere un altro protone H+ di acqua, che forma idrogeno solforato, che è un composto molto tossico.
SH- + H2O ⇔ h2S + OH-
Pertanto, piccole quantità di forma H in acqua2S e essendo esposto all'umidità dell'ambiente, il CAS emana un odore spiacevole tipico dell'idrogeno solforato.
Composti presenti durante la dissoluzione in acqua
Il risultato delle reazioni dell'acqua precedentemente indicate è che si forma CA (SH)2, Ca (Oh)2 e Ca (sh) (oh).
CAS + H2O → Ca (SH) (OH)
Ca (SH) (OH) + H2O → Ca (OH)2 + H2S
Reazione acida
Le stesse reazioni che si verificano nell'acqua fanno reagire il CAS con gli acidi che formano H2S.
CAS + 2 HCl → Cacl2 + H2S
Altre reazioni
Se viene riscaldata una soluzione di solfuro di calcio con zolfo, si ottengono gli ioni polisolfuro42- e s32-.
Se il CAS è riscaldato in aria secca o ossigeno puro, il composto viene ossidato nel caso di solfito di calcio3 E poi al caso di solfato di calcio4:
2 CAS + 3 O2 → 2 caso3
2 caso3 + O2 → 2 caso4
Con agenti ossidanti come il clorato di potassio kclo3, Nitrato di potassio Kno3 o biossido di piombo2 Si verificano reazioni violente.
Ottenimento
Il solfuro di calcio può essere preparato calcolando (riscaldamento a temperatura molto alta) il calcio (CA) e lo zolfo in atmosfera inerte, cioè non sono presenti ad esempio ossigeno o vapore acqueo.
Può servirti: cloro acido (HCLO2)Ca + S + calore → CAS
Può anche essere ottenuto riscaldando la custodia del solfato di calcio4 Con carbone:
Caso4 + 2 C → CAS + 2 CO2
Tuttavia, in quest'ultimo caso non si ottiene una casa pura, poiché reagisce inoltre con il caso4 formare CAO e così2.
CAS è anche generato dalla combustione dei rifiuti di carbone.
Presenza in natura
Il CAS è naturalmente presente nel minerale Oldhamite. Questo è un componente di alcuni meteoriti ed è importante per la ricerca scientifica che viene condotta sul sistema solare.
Si ritiene che la Oldhamita sia stata formata da condensa nella nebulosa che ha avuto origine il sistema solare. È anche presente nei vulcani.
 Il solfuro di calcio CAS si trova nel minerale Oldhamite, che è stato trovato in alcuni meteoriti. Leon Hupperichs/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Il solfuro di calcio CAS si trova nel minerale Oldhamite, che è stato trovato in alcuni meteoriti. Leon Hupperichs/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Inoltre, il solfuro di calcio è prodotto naturalmente dalla riduzione del caso4 (gesso) possibilmente per azione dei batteri.
Applicazioni
In materiali leggeri
Uno degli usi più diffusi del solfuro di calcio è stato come base per i composti leggeri. Queste sono sostanze che emettono luce visibile in determinate circostanze.
Nei composti luminescenti di CAS, questo agisce come base e gli attivatori vengono aggiunti alla struttura come cloruri di alcuni elementi come Cerio (CE3+) ed Europio (UE2+).
Il materiale derivante dall'unione CAS e l'attivatore viene utilizzato, ad esempio, nelle schermate dei tubi a raggi catodici che compongono le vecchie schermate di computer o computer o vecchi dispositivi TV.
 I monitor di computer antichi avevano tubi di raggi catodici in cui talvolta vengono utilizzati composti luminescenti di solfuro di calcio e attivatori. Autore: Andreas160578. Fonte: Pixabay.
I monitor di computer antichi avevano tubi di raggi catodici in cui talvolta vengono utilizzati composti luminescenti di solfuro di calcio e attivatori. Autore: Andreas160578. Fonte: Pixabay. Sono anche usati nelle attuali lampade di diodi che emettono la luce o LED (acronimo di inglese Diodi emettitori di luce).
Può servirti: ayaroína Lampada a LED. Alcuni possono contenere composti luminescenti di solfuro di calcio. Nessun autore leggibile dalla macchina fornita. APPer assunto (in base alle richieste di copyright). /CC BY-SA (http: // creativeCommons.Org/licenze/by-sa/3.0/). Fonte: Wikimedia Commons.
Lampada a LED. Alcuni possono contenere composti luminescenti di solfuro di calcio. Nessun autore leggibile dalla macchina fornita. APPer assunto (in base alle richieste di copyright). /CC BY-SA (http: // creativeCommons.Org/licenze/by-sa/3.0/). Fonte: Wikimedia Commons. Questi materiali sono utilizzati anche in dipinti luminosi e vernici.
In medicina
Il solfuro di calcio è stato considerato negli studi medici come un farmaco per trattare l'ipertensione arteriosa (alta pressione nelle arterie). Questa è una malattia che colpisce il sistema cardiovascolare di molte persone (vasi cardiaci e sanguigni).
CAS è considerato come un "donatore" di H2S. Questo gioca un ruolo importante nella regolazione del tono o della forza dei vasi sanguigni, quindi la somministrazione CAS potrebbe essere un possibile rimedio per trattare l'ipertensione.
 Il solfuro di calcio è stato studiato come possibile rimedio per l'alta pressione del sistema cardiovascolare di malati. Autore: Mohamed Hassan. Fonte: Pixabay.
Il solfuro di calcio è stato studiato come possibile rimedio per l'alta pressione del sistema cardiovascolare di malati. Autore: Mohamed Hassan. Fonte: Pixabay. Nel ottenere altri composti
Il solfuro di calcio consente di preparare altri composti come il nitrato di calcio CA (no3)2:
CAS + 2 HNO3 → Ca (no3)2 + H2S
È stato anche usato per ottenere carbonato di calcio Caco3. Per questo, una soluzione acquosa di CAS viene presentata al carbone2:
CAS + H2O + co2 → H2S + Caco3
Altre app
Il solfuro di calcio è anche usato come additivo per i lubrificanti e come agente di flottazione nell'estrazione minerale.
Rischi
Il solfuro di calcio può causare la pelle, gli occhi e l'irritazione del tratto respiratorio. Deve essere manipolato con precauzioni e adeguati strumenti di sicurezza.
È un composto molto tossico per la vita acquatica, quindi è pericoloso per questi ambienti.
Riferimenti
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Piombo, d.R. (editore). (2005). Manuale CRC di chimica e fisica. 85th CRC Press.
- Ropp, r.C. (2013). Gruppo 16 (O, S, SE, TE) Composti Terra alcalini. Calcio di solfuro. Nell'enciclopedia dei composti terrestri alcalini. Recuperato da ScienceDirect.com.
- Li, e.F. et al. (2009). Solfuro di calcio (CAS), al donatore di idrogeno solforato (H (2) S): un nuovo Draug antiipertensivo? Med Ipothes, 2009 set; 73 (3): 445-7. NCBI recuperato.Nlm.NIH.Gov.
- Casa j.E. e casa, k.A. (2016). Zolfo, selenio e telluum. Si verificano in zolfo. In chimica inorganica descrittiva (terza edizione). Recuperato da ScienceDirect.com.
- O.S. Biblioteca nazionale di medicina. (2019). Solfuro di calcio. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Birra, m. et al. (2014). Conversione del solfuro di calcio in carbonato di calcio durante il processo di recupero dello zolfo elementare dai rifiuti di gesso. Waste Manag, 2014 nov; 34 (11): 2373-81. NCBI recuperato.Nlm.NIH.Gov.
- « Caratteristiche di ricerca quantitativa, tecniche, esempi
- Proprietà di silicato di calcio, struttura, ottenimento, usi »

