Struttura di solfato di sodio (Na2SO4), proprietà, usi, ottenendo

- 2644
- 276
- Cosetta Messina
Lui solfato di sodio È un sale inorganico la cui formula chimica è na2SW4. È costituito da un solido bianco, presente in tre forme: anidro, ettoidrato (di poca esistenza) e decadroper (che è noto come sale di Glaubert); Quest'ultimo è la forma più abbondante di solfato di sodio.
Sodio solfato decaduto, NA2SW4· 10h2Oppure, fu scoperto nel 1625 da Glaubert nell'acqua di una primavera, che lo nominò salabilis (sale miracoloso) a causa delle sue proprietà medicinali.
 Vetro orologio con un campione di solfato di sodio. Fonte: Walkerma via Wikipedia.
Vetro orologio con un campione di solfato di sodio. Fonte: Walkerma via Wikipedia. Il solfato di sodio ha numerose applicazioni nell'industria tessile e di carta, nonché nella produzione di vetro. I suoi usi sono estesi con applicazioni termiche, tra cui la fornitura ambientale di calore e il raffreddamento dei laptop.
Il solfato di sodio è un composto a bassa tossicità e le sue azioni dannose, sono fondamentalmente meccanici e non chimici. Per ragioni cristallografiche questo sale, come la sua controparte di poetassio, K2SW4, presenta strutture quadro e polimorfiche.
[TOC]
Struttura
Sale anidro
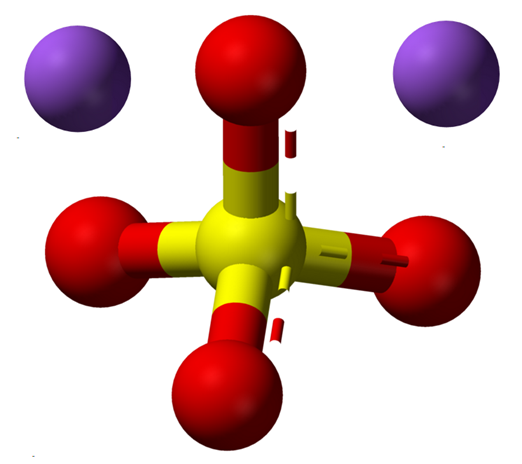 Ioni anidro di solfato di sodio. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Ioni anidro di solfato di sodio. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] La formula NA2SW4 Indica una volta gli ioni Na nei cristalli di sale+ E così42- Sono in una relazione 1: 2; cioè, per ogni due cationi na+ C'è un anione così42- Interagire con loro per attrazione elettrostatica (immagine superiore).
Certo, questo vale per il NA2SW4 anidro, senza molecole d'acqua coordinate con sodio all'interno dei cristalli.
 Solfato di sodio
Solfato di sodio Nonostante sia un aspetto semplice, la sua descrizione strutturalmente è complessa. Poi un2SW4 Presenta il polimorfismo, con fino a cinque fasi cristalline: I, II, III, IV e V, le cui temperature di transizione sono 180, 200, 228, 235 e 883 ºC, rispettivamente.
Sebbene non ci siano riferimenti che lo certificano, il NA2SW4Devo essere quello che ha una struttura cristallina esagonale, più densa rispetto al na ortorrombico2SW4III, nei cui cristalli il na+ Forma di tetraedra (Nao4) e Octaedros (Nao6) coordinazione; cioè, può essere circondato da quattro o sei anioni così42-.
Decayedratada sale
Nel frattempo, la struttura cristallina monoclinica del suo idratato più importante, NA2SW4· 10h2Oppure è più semplice. In esso sono praticamente le molecole d'acqua che interagiscono o si coordinano con il NA+ Nell'ottaedra Na (h2O)6+, Con il SO42- Contribuire a malapena a una stabilità sufficiente al vetro da esistere in una fase solida.
Può servirti: prima rivoluzione chimicaTuttavia, il suo punto di fusione (32,38 ºC) molto più basso di quello del sale anidro (884 ºC) dimostra come le molecole d'acqua e i loro ponti idrogeno indeboliscono le interazioni ioniche, più forti, in NA2SW4.
Proprietà
Nomi
-Sodio solfato (Iupac)
-Sale glauber (disidrata)
-Sala Miracollous (Decayroper)
-Solfato di disodio.
Massa molare
142,04 g/mol (anh IDRO)
322,20 g/mol (decidrato)
Aspetto fisico
Solido cristallino igroscopico bianco
Odore
Gabinetto
Gusto
Amaro e salino
Densità
2.664 g/cm3 (anidro)
1.464 g/cm3 (Daidrato)
Nota come le molecole d'acqua all'interno dei cristalli le fanno dilattare e, quindi, diminuiscono la loro densità.
Punto di fusione
884 ºC (anidro)
32,38 ºC (decidrato)
Punto di ebollizione
1.429 ºC (anidro)
Solubilità dell'acqua
4,76 g/100 ml (0 ºC)
13,9 g/100 ml (20 ºC)
42,7 g/100 ml (100 ºC)
Tutti i valori di solubilità corrispondono al sale anidro, che è abbastanza solubile in acqua a tutte le temperature.
La solubilità aumenta bruscamente tra 0 ºC e 38,34 ºC, osservando che in questa gamma di temperature la solubilità aumenta più di 10 volte. Tuttavia, dalla solubilità di 32,38 ºC è indipendente dalla temperatura.
Succede che a temperatura 32,8 ºC il solfato di sodio decaduto si dissolva nella propria acqua cristallina. Pertanto, un equilibrio tra sale decadicato, sale anidra e soluzione satura di solfato di sodio.
Finché viene mantenuta la condizione a tre fasi, la temperatura rimarrà costante, il che consente alla temperatura dei termometri di calibrare.
D'altra parte, le solubilità per il sale eptaidrato sono:
19,5 g/100 ml (0 ºC)
44,0 g/100 ml (20 ºC)
Si noti che a 20 ° C il sale eptaidrato è tre volte più solubile che anidro.
Indice di rifrazione
1.468 (anidro)
1.394 (decidrato)
Stabilità
Stabile in condizioni di archiviazione consigliate. Incompatibile con acidi e basi forti, alluminio e magnesio.
Decomposizione
Quando viene riscaldato alla decomposizione, emette un fumo tossico di ossido di zolfo e ossido di sodio.
ph
Una soluzione acquosa al 5 % ha un pH di 7.
Reattività
Il solfato di sodio si dissocia in soluzione acquosa in 2 Na+ E così42-, che consente allo ione solfato di essere combinato con il BA2+ Per precipitare il solfato di bario. Praticamente aiuta a spostare gli ioni bario dei campioni di acqua.
Può servirti: transaminazioneIl solfato di sodio diventa solfuro di sodio per reazione ad alte temperature con carbone:
N / a2SW4 + 2 c => na2S +2 co2
Glaubert's Salt, Naso4.10h2O reagisce con carbonato di potassio per produrre carbonato di sodio.
Applicazioni
Industria cartacea
Il solfato di sodio viene utilizzato nella produzione di pasta di carta. Viene utilizzato nell'elaborazione della carta kraft, che non contiene lignina o si sottomette al processo di sbiancamento, motivo che gli dà una grande resistenza. Inoltre, viene utilizzato nella produzione di cartone.
Detergenti
Viene usato come materiale di riempimento del detergente sintetico per l'uso a casa, aggiungendo al detergente per ridurre la tensione superficiale.
Bicchiere
Viene utilizzato nella produzione di vetro per ridurre o eliminare la presenza di piccole bolle d'aria nel vetro fuso. Inoltre, elimina la formazione di scorie durante il processo di raffinazione del vetro fuso.
Industria tessile
Il solfato di sodio viene usato come mordente, poiché facilita l'interazione dei coloranti con le fibre di tessuto. Il solfato di sodio detaidratato viene utilizzato nel test di colorante.
Inoltre, il solfato di sodio viene usato come agente di stampa tintura di diluente e ausiliario; come coloranti diretti, coloranti di zolfo e altri agenti che favoriscono la colorazione del cotone. Viene anche usato come agente che ritarda i coloranti diretti della seta.
Medicinale
Il solfato di sodio decahride è usato come lassativo, poiché è poco assorbito nell'intestino, e quindi rimane alla luce di questo causando un aumento del volume. Ciò stimola l'aumento delle contrazioni peristaltiche che inducono l'espulsione del contenuto intestinale.
Il solfato di sodio è un antidoto per controllare l'avvelenamento con bario e sali di piombo. Il sale di Glaubert è efficace per l'eliminazione di alcuni farmaci eccessivamente ingeriti; Ad esempio, paracetamolo (acetoaminofene).
Inoltre, viene utilizzato per fornire poveri elettroliti con presenza in soluzioni isoosmotiche.
Agente di asciugatura
Solfato di sodio perché è un reagente inerte, viene utilizzato per la rimozione dell'acqua dalle soluzioni di composti organici.
Materia prima
Il solfato di sodio viene usato come materia prima per la produzione di numerose sostanze, tra cui: solfuro di sodio, carbonato di sodio e solfato di ammonio.
Può servirti: gascromatografiaOttenimento
Il solfato di sodio è ottenuto mediante estrazione di estrazione e reazioni chimiche.
Estrazione mineraria
Ci sono tre minerali o minerali che vengono sfruttati con prestazioni commerciali: Therardita (NA2SW4), Mirabilita (NA2SW4· 10h2O) e la glaubarita (na2SW4·Caso4).
In Spagna, i depositi di Therardita e Mirabilita sono sfruttati dall'estrazione sotterranea di gallerie e pilastri. Nel frattempo, la glauberita è ottenuta all'aperto, da grandi zattere che sono posizionate sul serbatoio minerale.
Il terreno viene preparato con esplosioni a bassa intensità per produrre una porosità che consente la lisciviazione del solfato di sodio. La fase di produzione si verifica con irrigazione dell'irrigatore con acqua dolce dalla glauberita, la cui lisciviazione si propaga in modo discendente.
Viene raccolta la salamoia di solfato di sodio, il residuo di solfato di calcio viene riempito.
Produzione chimica
Il solfato di sodio viene ottenuto durante la produzione di acido cloridrico attraverso due processi: il processo di Mannheim e il processo Hardgrenave.
Processo di Mannheim
Viene fatto in grandi forni in acciaio e con una piattaforma di reazione in acciaio da 6 m. La reazione si verifica tra cloruro di sodio e acido solforico:
2 NaCl +H2SW4 => 2 HCl +Na2SW4
Processo hardreave
Implica la reazione di cloruro di sodio, ossido di zolfo, ossigeno e acqua:
4 NaCl + 2 SO2 + O2 + 2 h2O => 4 hcl +na2SW4
Altri
Il solfato di sodio si verifica nella reazione di neutralizzazione tra idrossido di sodio e acido solforico:
2 NaOH +H2SW4 => Na2SW4 + H2O
Il solfato di sodio è un sottoprodotto della produzione di numerosi composti. Viene estratto dai rifiuti liquidi scaricati durante la produzione del viscoso e del cellophane. Anche nella produzione di dicromato di sodio, fenoli, acido borico e carbammato di litio.
Rischi
Il solfato di sodio è considerato un composto a bassa tossicità. Tuttavia, può produrre alcuni danni alla persona che lo usa inappropriato.
Ad esempio, puoi causare irritazione agli occhi, arrossamento e dolore. Nella pelle può causare irritazione e allergia in alcune persone. La sua ingestione può causare irritazione del tratto digestivo con nausea, vomito e diarrea. E infine, la sua inalazione produce irritazione nel tratto respiratorio.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Solfato di sodio. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Solfato di sodio. Database PubChem. CID = 24436. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- B. N. Mehrotra. (1978). La struttura cristallina di Na2SW4Iii. Recuperato da: rruff-2.geo.Arizona.Edu
- Glauberita-thenardita (solfato di sodio). [PDF]. Recuperato da: igme.È
- « Struttura di ossido di zinco (ZnO), proprietà, usi, rischi
- Caratteristiche blu di lattofenolo, composizione, preparazione, usi »

