Solvatazione
- 3278
- 445
- Lino Lombardi
Cos'è la solvatazione?
IL Solvatazione È l'unione fisica e chimica tra particelle di soluto e solvente in una soluzione. Si differenzia dal concetto di solubilità nel fatto che non vi è alcun equilibrio termodinamico tra un solido e le sue particelle disciolte.
Questa unione è responsabile dei solidi disciolti "scompaiono" in vista degli spettatori; Quando in realtà, le particelle diventano molto piccole e finiscono "avvolte" dai fogli di molecole di solvente, il che li rende impossibili osservarle.

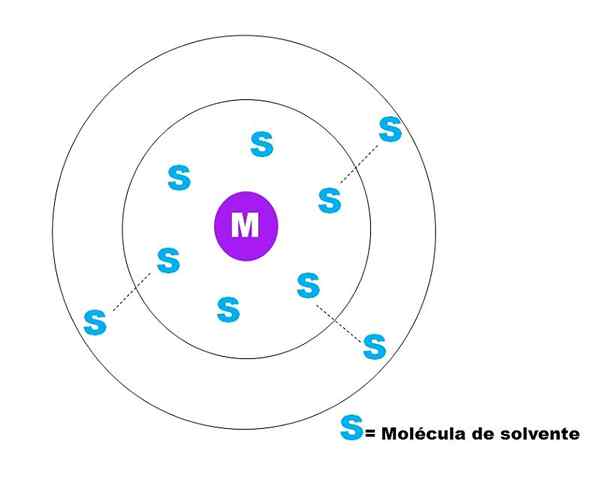
Nell'immagine superiore è rappresentato uno schizzo molto generale della solvatazione di una particella M. M può essere a posto (m+) o una molecola; E S è la molecola di solvente, che può essere qualsiasi composto in stato liquido (sebbene possa anche essere gas).
Si noti che M è circondato da sei s, che compongono ciò che è noto come Sfera di solvatazione primaria. Altre molecole M a una distanza più elevata interagiscono dalle forze di van der waals con la prima, formando una sfera di solverazione secondaria e così via fino a quando non è evidente qualsiasi ordinamento.
Processo di solvatazione
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Molecolare, come è il processo di solvatazione? L'immagine superiore riassume i passaggi necessari.
Le molecole di solvente, blu, sono inizialmente ordinate di interagire tra loro (S-S); E le particelle (ioni o molecole) di soluto, viola, fanno lo stesso con interazioni M-M forti o deboli.
Per far sì che la solvatazione si verifichi, sia il solvente che il soluto devono espandersi (seconda freccia nera) per consentire le interazioni con solvente (M-S).
Ciò implica necessariamente una diminuzione delle interazioni solvente e solvente; diminuzione che richiede energia e quindi questo primo passo è endotermico.
Una volta che il soluto e il solvente si sono espansi molecolari, sia di mescolare che scambiare posti nello spazio. Ogni cerchio viola della seconda immagine può essere paragonato a quello della prima immagine.
Può servirti: calcio: proprietà, struttura, ottenere, usiUn cambiamento nel grado di ordinazione delle particelle può essere dettagliato nell'immagine; ordinato all'inizio e disordinato alla fine. Di conseguenza, l'ultimo passo è esotermico, poiché la formazione delle nuove interazioni stabilizza tutte le particelle della soluzione.
Aspetti energetici
Dietro il processo di solvatazione, ci sono molti aspetti energetici che devono essere presi in considerazione. Primo: le interazioni S-S, M-M e M-S.
Quando le interazioni M-S, cioè, tra il soluto e il solvente, sono molto superiori (forti e stabili) rispetto a quelle dei singoli componenti, si parla di un processo di solverazione esotermica; E quindi, l'energia viene rilasciata nell'ambiente, che può essere verificata misurando l'aumento della temperatura con un termometro.
Se, al contrario, le interazioni M-M e S-S sono più forti degli M-S, allora per "espandersi" avrà bisogno di più energia di quella che guadagnano una volta culminata la solvatazione.
Si parla quindi di un processo di risoluzione endotermica. Essendo questo caso, c'è una diminuzione della temperatura, o di ciò che è lo stesso, i dintorni si raffreddano.
Esistono due fattori fondamentali che governano se un soluto si dissolve o meno in un solvente. Il primo è il cambiamento di soluzione di dissoluzione (ΔHDis), Come spiegato, e il secondo è il cambiamento di entropia (ΔS) tra il soluto e il soluto disciolto. Generalmente, ΔS è associato all'aumento del disturbo menzionato anche sopra.
Interazioni intermolecolari
È stato detto che la solvatazione è il risultato dell'unione fisica e chimica tra il soluto e il solvente; Tuttavia, come sono esattamente queste interazioni o sindacati?
Se il soluto è uno ione, m+, Vengono prodotte le cosiddette interazioni ion-dipolo (M+-S); E se è una molecola, allora ci saranno interazioni dipolo-dipolo o forze di dispersione di Londra.
Può servirti: cicloesano: struttura, usi, conformazioniQuando si parla di interazioni dipolo-dipolo, si dice che ci sia un momento di dipolo permanente in m e s. Pertanto, la regione ricca di elettroni Δ- di m interagisce con la povera regione di elettroni Δ+ di S. Il risultato di tutte queste interazioni è la formazione di diverse sfere di solvatazione intorno a M.
Inoltre, ci sono altri tipi di interazioni: il coordinatore. Qui, le molecole di S forma coordinamento collegamenti (o dativi) con M, formando varie geometrie.
Una regola fondamentale per memorizzare e prevedere l'affinità tra il soluto e il solvente è: uguale si dissolve uguale. Pertanto, le sostanze polari si dissolvono con grande facilità nei solventi ugualmente polari; e sostanze apolari, dissolversi nei solventi apolari.
Differenze tra solvatazione e idratazione
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Come è diversa la risoluzione dell'idratazione? I due processi identici, tranne perché le s, della prima immagine, sono sostituiti da quelli dell'acqua, H-O-H.
Nell'immagine superiore puoi vedere un catione m+ circondato da sei molecole2O. Si noti che gli atomi di ossigeno (rosso) sono diretti al carico positivo, perché è il più elettronegativo e quindi ha la più grande densità negativa Δ-.
Dietro la prima sfera di idratazione, altre molecole d'acqua sono raggruppate da ponti idrogeno (OH2-OH2). Queste sono interazioni di tipo ionico-dipolo. Tuttavia, le molecole d'acqua possono anche formare legami di coordinamento con il centro positivo, specialmente se è metallico.
Quindi, il famoso Aquocomplejos, M (Oh2)N. Come n = 6 nell'immagine, le sei molecole sono orientate attorno a M in un ottaedro di coordinazione (la sfera interna dell'idratazione). A seconda delle dimensioni di m+, L'entità del suo carico e la sua disponibilità elettronica, detto sfera, può essere più piccola o più grande.
Può servirti: ossido cromatico (III): struttura, nomenclatura, proprietà, usiL'acqua è forse il solvente più sorprendente di tutti: dissolve una quantità incommensurabile di soluti, è un solvente troppo polare e ha una costante dielettrica anormalmente alta (78.5 k).
Esempi di risoluzione
Di seguito sono riportati tre esempi di solvatazione in acqua.
Cloruro di calcio
Quando si dissolve il cloruro di calcio in acqua, il calore viene rilasciato quando i cationi vengono risolti2+ e anioni cl-. Il CA2+ È circondato da una serie di molecole d'acqua pari o superiori a sei (CA2+-OH2).
Inoltre, il CL- È circondato da atomi di idrogeno, la regione Δ+ dell'acqua (CL--H2O). Il calore rilasciato può essere utilizzato per le masse di ghiaccio che si scioglie.
Urea
Nel caso dell'urea, è una molecola organica con struttura H2N-co-nh2. Durante la risoluzione, molecole H2O formare ponti idrogeno con i due gruppi di aming (-nh2-OH2) e con il gruppo carbonile (c = o- h2O). Queste interazioni sono responsabili della loro grande solubilità in acqua.
Anche la sua dissoluzione è endotermica, cioè raffredda il contenitore d'acqua dove viene aggiunto.
Nitrato di ammonio
Il nitrato di ammonio, come l'urea, è un soluto che raffredda la dissoluzione dopo la solvatazione dei suoi ioni. Il NH4+ Solvata in modo simile a CA2+, Anche se probabilmente perché è la geometria tetraedrica possiede meno molecole H2O intorno a lui; E no3- Solvata allo stesso modo degli anioni CL- (OH2-O2No- h2O).
Riferimenti
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). Apprendimento del Cengage.
- Belford r. (S.F.). Processi di solvatazione. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Guppy Surf. (S.F.). Il processo di solvatazione. Estratto da: surfgupy.com

