Composizione, tipi ed esempi di soluzioni cristalloidi
- 2458
- 756
- Rosolino Santoro
IL Soluzioni cristalloidi Sono quelli formati dalla dissoluzione di un elettrolita e di altre piccole molecole solubili in acqua, utilizzate in procedure di routine cliniche come la regolazione del volume dei fluidi del sistema circolatorio. In semplici termini chimici: queste soluzioni non sono altro che soluzioni di mining acquose e diluite.
Le soluzioni cristalloidi svolgono un ruolo importante nelle terapie cliniche come i fluidi per infusioni endovenose per casi di emorragia, disidratazione, ipovolemia e infezioni. Di solito, la sua concentrazione salina è isotonica, il che significa che il numero dei suoi ioni disciolti è paragonabile a quello del plasma sanguigno.
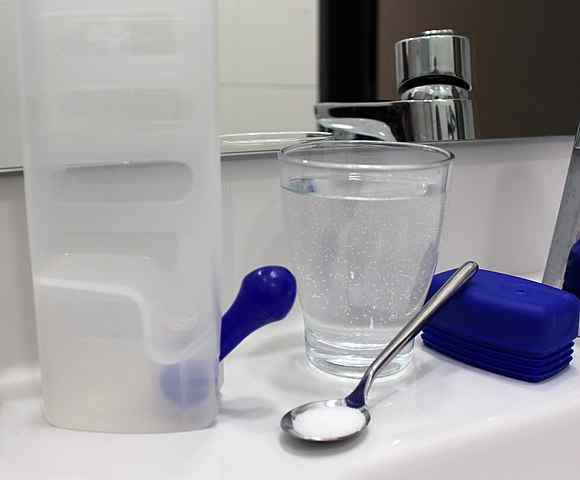
 Una soluzione cristalloide può essere preparata semplicemente dissolvendo il sale e altri soluti in acqua a una concentrazione moderata. Fonte: Rillke/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)
Una soluzione cristalloide può essere preparata semplicemente dissolvendo il sale e altri soluti in acqua a una concentrazione moderata. Fonte: Rillke/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) Le soluzioni cristalloidi quindi non causano alterazioni osmotiche, ma forniscono un volume adeguato di liquido in modo che il sangue continui a irrigare dal sistema circolatorio. In questo modo, si ottiene che il cuore pompa il sangue diluito e possa fornire ossigeno ai tessuti.
Un esempio di soluzione cristalloide è la normale soluzione salina, che contiene NaCl ad una concentrazione dello 0,9%. Tuttavia, a seconda del caso clinico, possono essere scelte altre soluzioni, con componenti, concentrazioni e tipi diversi.
[TOC]
Composizione di soluzioni cristalloidi
Tutte le soluzioni cristalloidi sono basate su microrganismi sterilizzati o gratuiti, quindi questo è il suo solvente preferito. Altrimenti, non potrebbero integrarsi sani nel nostro corpo e causare una reazione indesiderabile. Come soluzione o soluzione che è, ha anche soluti, che in sostanza sono sali minerali o elettroliti forti.
Le vendite possono essere diverse, purché contribuiscano a concentrazioni moderate gli ioni Na+, AC2+, K+ e cl-. Oltre ai sali inorganici, possono anche avere soluti organici molto solubili in acqua come acetate, gluconti e lattati. Inoltre, alcune di queste soluzioni contengono glucosio (destrosio).
Può servirti: idrossiapatiteLe concentrazioni di questi sali o soluti sono molto varie e sono espresse in percentuali, milligrammi di decilitri (mg/dl), molarità o osmolarità. La scelta dell'uno o dell'altro dipenderà dai criteri clinici.
Ragazzi
All'inizio è stato detto che le soluzioni cristalloidi sono spesso utilizzate per fornire volume di liquido al sistema circolatorio. Nel processo, a seconda della sua tonicità, il plasma sanguigno soffre o cambiamenti non osmotici, che promuovono o favoriscono alcuni stati desiderati nel paziente.
Pertanto, l'unica cosa che distingue una soluzione cristalloide da un'altra non è la natura chimica del suo soluto, ma la sua tonicità; Cioè, se è una soluzione ipertonica, isotonica o ipotonica.
Ipertonico
Una soluzione cristalloide ipertonica è quella la cui concentrazione salina è superiore a quella trovata nel plasma nel sangue. Pertanto, l'acqua migra dall'interno delle cellule al plasma che ha aumentato la sua tonicità a causa della presenza della soluzione cristalloide ipertonica. Un esempio di questo tipo di soluzione è quello del NaCl al 3%, in particolare più concentrato rispetto alla soluzione salina normale allo 0,9%.
Queste soluzioni sono controindicate per la maggior parte dei casi clinici, ad eccezione di coloro che presentano sequele neurologiche.
Isotonico
Una soluzione cristalloide isotonica è quella la cui concentrazione salina è comparabile o identica a quella del plasma ematico e quella dell'interno cellulare. Pertanto, non esiste uno scambio di acqua tra i due media. Un esempio di questo tipo di soluzione è lo 0,9%di NaCl, già menzionato sopra.
Ipotonico
E infine, una soluzione cristalloide ipotonica è quella la cui concentrazione salina è inferiore a quella del plasma ematico e del compartimento intracellulare o dello spazio. Questa volta l'acqua si sposta nell'interno della cella fino a raggiungere l'equilibrio. Un esempio di questo tipo di soluzione è lo 0,45% di NaCl.
Può servirti: metalli alkalinotherrousCome per le soluzioni cristalloidi ipertoniche, gli ipotonici sono controindicati per la maggior parte dei casi clinici, in particolare per quelli in cui esiste il rischio di edema cerebrale.
Esempi di soluzioni cristalloidi
Alcuni esempi di soluzioni cristalloidi saranno menzionati e descritti di seguito. La differenza tra l'uno e l'altro si troverà nell'identità dei suoi elettroliti o sali disciolti.
Soluzione salina normale
La soluzione salina normale ha una composizione NaCl allo 0,9%, è isotonica ed è anche la soluzione cristalloide più ricorrente, poiché serve a trattare gli infinito di casi di disidratazione comuni; come quelli causati da diarrea, shock, vomito, sanguinamento, tra gli altri. Tuttavia, viene evitato l'uso nei pazienti con problemi renali o cardiaci.
Soluzione lattata
Conosciuto anche come soluzione Ringer o Hartmann (sebbene differiscano leggermente nelle loro concentrazioni ioniche), è composto da una miscela di cloruro di sodio, lattato di sodio, cloruro di calcio e cloruro di potassio.
La sua composizione salina è quella che ricorda quella del plasma sanguigno, quindi è il tipo isotonico. Viene usato come fluido o fluido a regolamento per casi di ustioni, traumi, squilibrio elettrolitico, acidosi metabolica. Tuttavia, è controindicato per i pazienti che soffrono di ipercalcemia.
Il lattato viene metabolizzato nel nostro corpo e finisce per trasformare in bicarbonato. Questa soluzione può anche contenere anioni di gluconato, nonché determinate quantità di magnesio, MG2+.
Soluzione di glucosio
Conosciuto anche come soluzione cristalloide di destrosio, è disponibile in due concentrazioni: 5 e 10% (D5 o D10, rispettivamente). Questo è inizialmente ipotonico, ma viene trasformato in isotonico una volta assorbito il glucosio, fornendo acqua ai reni. Sebbene fornisca una quantità significativa di calorie, è controindicato per i pazienti che soffrono di iperglicemia.
Può servirti: acido elagico: struttura, proprietà, ottiene, posizione, usiA differenza di altre soluzioni cristalloidi, queste sono dolci. I più dolci hanno concentrazioni superiori al 10% (D20, D30, D50, ecc.) E sono destinati ai pazienti con edema polmonare e cerebrale. D'altra parte, riducono il catabolismo delle proteine, proteggono il fegato e aiutano a combattere i crolli circolatori.
Soluzioni saline ipertoniche e ipotoniche
Le soluzioni saline ipertoniche (NaCl 3 e 5%) sono usate per fornire liquido ai pazienti in fiamme, indurre iperosmolarità e alleviare le insufficienze renali. D'altra parte, soluzioni saline ipotoniche (0,45% di NaCl o concentrazioni inferiori), controllano ipernatriemia e sono controindicate per la combustione dei pazienti in fiamme.
Pertanto, uno fornisce gli effetti contrari all'altro; Quando la soluzione ipertonica è indispensabile, l'ipotonico è disapprovato e viceversa.
Il meccanismo alla base di tutte le soluzioni cristalloidi si basa sull'equilibrio osmotico e sull'acqua tra fluidi intracellulari.
Riferimenti
- Lewis Sr et al. (3 agosto 2018). Colloidi o cristalloidi per la sostituzione del fluido nelle persone critiche. La collaborazione di Cochrane. Recuperato da: Cochrane.org
- Epstein em, waseem m. (29 novembre 2019). Fluidi cristalloidi. In: Statpearls. Treasure Island (FL): Statpearls Publishing 2020 -. Recuperato da: NCBI.Nlm.NIH.Gov
- Wikipedia. (2020). Espansore del volume. Recuperato da: in.Wikipedia.org
- Elsevier b.V. (2020). Cristalloide. Scienceirect. Estratto da: ScienceDirect.com
- Sheila Bouie. (2020). Cristalloidi: definizione ed esempio. Studio. Recuperato da: studio.com

