Soluzione ipertonica
- 879
- 225
- Baldassarre Ross
Spieghiamo quali sono le soluzioni ipertoniche, le loro caratteristiche, quali sono l'uso, le differenze con l'ipotonico e danno diversi esempi
Molti saranno sorpresi di sapere che il modo in cui le piante assorbono l'acqua attraverso le loro radici e il modo in cui le dita delle mani sono rugose quando fanno il bagno nell'acqua di mare, sono strettamente correlate.
Entrambe le cose accadono grazie all'esistenza di una membrana che funziona come un filtro e una soluzione ipertonica che succhia letteralmente l'acqua attraverso di essa. Ma cos'è una soluzione ipertonica?
In questo articolo, questa domanda verrà data risposta e saranno presentate anche le caratteristiche più rilevanti delle soluzioni ipertoniche, a cosa servono, come si distinguono da altri tipi di soluzioni e alcuni esempi dello stesso.
Cos'è una soluzione ipertonica?
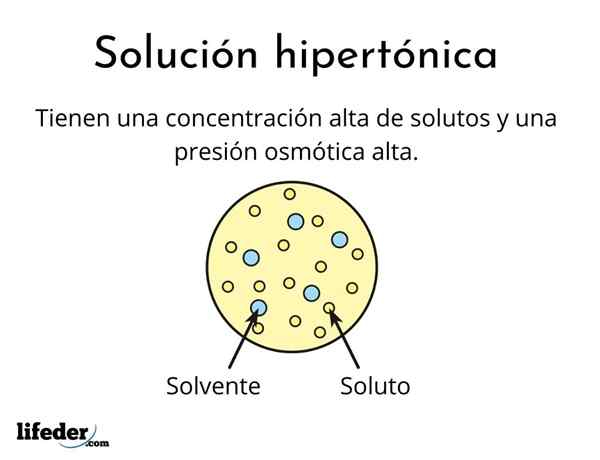
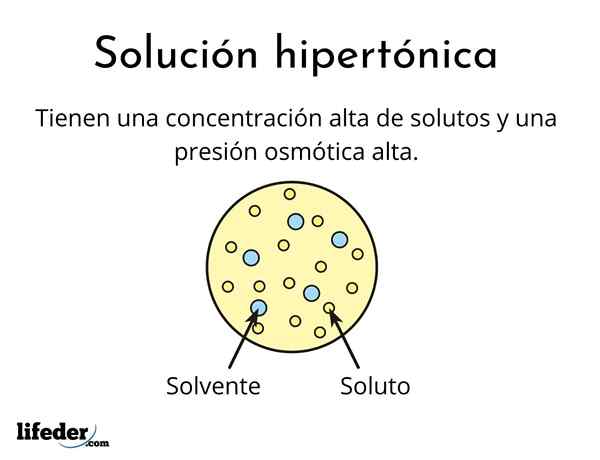
UN soluzione ipertonica È uno che contiene una concentrazione totale di soluti osmolari attivi maggiore di quella di un'altra soluzione di riferimento. Osmolarily Active significa che i soluti non possono attraversare un tipo speciale di membrana (simile a un tessuto) che funge da filtro o filtro, cioè, lascia che l'acqua passi e non alle particelle di soluto.
Questa alta concentrazione di soluti fa sì che soluzioni ipertoniche abbiano un'alta pressione osmotica. Questa pressione è ciò che succhia praticamente l'acqua attraverso la membrana, che si chiama osmosi.
La parola ipertonica proviene dal prefisso greco Hyper-, che significa "sopra, o sopra" e "toni", che significa tensione o pressione, così ipertonico significa letteralmente "che ha una maggiore pressione o tensione".
È importante tenere presente che, in biologia e medicina, a condizione che si parli di soluzione ipertonica, si riferisce a una soluzione più concentrata della soluzione contenuta nel sangue, che si chiama plasma ematico.
Caratteristiche delle soluzioni ipertoniche
Le soluzioni ipertoniche hanno alcune caratteristiche di base:
Sono formati da un solvente e almeno un soluto
Non nessuna soluzione può essere ipertonica, anche quindi è molto concentrato. Il soluto non deve essere in grado di attraversare la membrana, mentre l'acqua deve essere in grado di passarla senza problemi, altrimenti la pressione osmotica non viene generata.
Hanno alte concentrazioni di soluti
Questo è ciò che li rende soluzioni ipertoniche. Come menzionato un momento fa, le soluzioni ipertoniche sono più concentrate del sangue.
Può servirti: distillazione frazionaria: processo, attrezzatura, applicazioni, esempiPossono avere composizioni diverse
Una soluzione ipertonica può contenere un singolo soluto come sale o può contenere una miscela di soluti come sali e zuccheri, ad esempio.
I solutos possono essere ionici, neutrali o entrambi
Le vendite contengono ioni con cariche elettriche che non consentono loro di attraversare la membrana, quindi sono piccole. Altri soluti non hanno ioni, ma sono grandi e grassi e non si adattano ai buchi.
Hanno un'alta pressione osmotica
Come accennato in precedenza, le soluzioni ipertoniche hanno una pressione osmotica maggiore del sangue.
Possono disidratare le cellule
Soluzioni ipertoniche estrarre l'acqua da cellule lasciandole come uvetta. Ecco perché le nostre mani e i nostri piedi sono rugosi quando facciamo il bagno sulla spiaggia.
Per cosa sono le soluzioni ipertoniche?
Le soluzioni ipertoniche hanno molti usi nella vita quotidiana e anche in medicina. Alcuni degli usi più comuni sono:
Sono abituati per mantenere il cibo
- Esempio: le pesche nello sciroppo non marciscono perché lo sciroppo ha molto zucchero disciolto ed è una soluzione molto ipertonica. Dal disidratazione delle cellule, le soluzioni ipertoniche non consentono funghi e batteri nel cibo, perché muoiono di sete. Ciò consente agli alimenti di durare di più.
Servono a ridurre l'infiammazione
- Esempio: quando qualcuno ha un incidente e colpisce la testa, ci sono molte volte un'infiammazione nel cervello. Per curare il paziente, i medici iniettano una soluzione salina del 7,5%. Questa soluzione succhia praticamente l'acqua, riducendo l'infiammazione nel cervello.
Servono a sostituire gli elettroliti.
- Esempio: il sodio è un elettrolita che dobbiamo vivere e quando un paziente ha poca sodio nel sangue, viene iniettata una soluzione salina del 7,5% per riempire il sodio che è stato perso.
Sono usati per il cibo parenterale
- Esempio: quando le persone non possono mangiare attraverso la bocca o attraverso un tubo, si nutrono in una soluzione ipertonica che contiene un tipo di zucchero chiamato glucosio.
Differenze con soluzioni ipotoniche e isotoniche
Proprio come ci sono soluzioni ipertoniche, ci sono anche soluzioni ipotoniche e isotoniche. La differenza tra quest'ultima e le soluzioni ipertoniche è la sua concentrazione. Le soluzioni ipotoniche sono quelle meno concentrate del sangue e isotoniche hanno la stessa concentrazione del sangue.
Ad esempio, l'acqua pura, poiché non ha nulla di soluto, è ipotonica, mentre l'acqua di cocco ha sali e zuccheri con una concentrazione quasi uguale a quella del sangue, quindi è isotonico.
Oltre a differenziarsi in base alla loro concentrazione, le soluzioni iper, ipo e isotoniche differiscono nel modo in cui influenzano le cellule.
L'immagine seguente mostra l'effetto dei diversi tipi di soluzioni sui globuli rossi (le piccole cellule che rendono il sangue rosso).
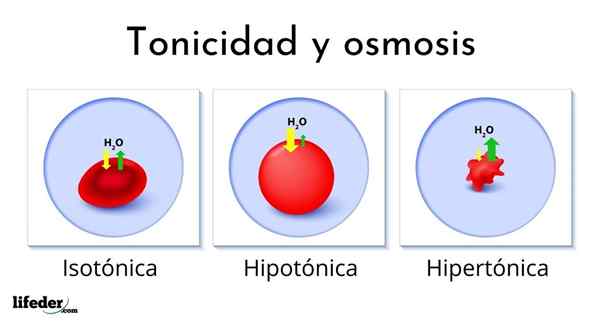
Se i globuli rossi vengono introdotti in una soluzione ipertonica, estrae l'acqua, disidratandoli e lasciandoli rugosi come un passaggio.
D'altra parte, se vengono introdotti in una soluzione ipotonica, i globuli rossi assorbono l'acqua e si gonfiano, anche scoppiando come un palloncino che si gonfia troppo. Infine, se vengono introdotti in una soluzione isotonica, l'acqua all'interno e all'esterno dei globuli rossi sarà in equilibrio, quindi non succede nulla.
Esempi di soluzioni ipertoniche
Sciroppo di zucchero
 Pesche in sciroppo
Pesche in sciroppo Lo sciroppo in cui sono conservati pesche e altri frutti contiene concentrazioni di zucchero molto elevate, quindi è una soluzione ipertonica.
La salamoia
La salamoia è una soluzione di acqua e sale con concentrazioni molto elevate tra il 3,5% e il 25%, che possono diventare quasi 30 volte più concentrata del sangue (cioè è molto ipertonico).
L'aceto
Un aceto comune è una soluzione ipertonica, poiché ha una concentrazione tra il 3% e il 5% di acido acetico. Le riduzioni di aceto balsamico sono ancora più concentrate.
Può servirti: dimetilammina ((CH3) 2nh): struttura, proprietà, usi, rischiLo stesso sangue delle nostre vene, dopo aver sudato molto.
Durante l'esercizio e la sudorazione, il corpo elimina l'acqua e i sali, ma elimina più acqua dei sali (il sudore è ipotonico) in modo che il sangue si concentri e diventa ipertonico.
Acqua di mare
L'acqua di mare contiene molti sali disciolti, con una concentrazione totale di circa il 3,5%, il che lo rende ipertonico. Ecco perché l'acqua di mare rughi le nostre dita.
Bevande zuccherate
Le bevande di cola e altre bevande zuccherate possono contenere fino al 10% di zucchero, nonché sali e altri soluti con concentrazioni maggiori del sangue.
5% di soluzione di destrosio e 0,45% di cloruro di sodio (D5 ½ NS)
Questo è un esempio di una soluzione ipertonica che viene utilizzata per nutrire le persone che normalmente non possono mangiare vicino alla bocca.
25% mannitolo
Questa è una soluzione spesso utilizzata per trattare gli shock sulla testa. È quattro volte più concentrato del sangue.
7,5% di soluzione salina
È una soluzione salina abbastanza concentrata che viene anche iniettata con alcuni pazienti con determinate malattie nelle vene.
Succhi commerciali
Tutti i succhi che vengono acquistati nel supermercato e che non sono naturali, hanno concentrazioni di zucchero molto elevate che li rendono ipertonici.
Riferimenti
- Sweeney J. Gestione dell'ipernatriemia. Assistenza infermieristica. Settembre 2010; 40 (9): 63.
- Salamoia. Wikipedia. 2021. Preso da.Wikipedia.org/wiki/salamoia.
- Acqua di mare. Wikipedia. 2021. Preso da.Wikipedia.Org/wiki/acqua di mare.
- Chavaltamrong B, Pidatcha P, Thavisri U. Elettroliti, zucchero, calorie, osmolarità e pH delle bevande e acqua di cocco. SALUTE PUBBLICA SUDEST ASIAN J TROP MED. Settembre 1982; 13 (3): 427-431.
- 5% di destrosio e 0.Iniezione di cloruro di sodio 45%, USP. FDA. 2006. Tratto da AccessData.FDA.Gov/Drugsatfda_docs/etichetta/2006/017607s123lbl.PDF.
- Llorente G, Niño MC. Manitol contro soluzione salina ipertonica in neuroanestesia. Rivista di anestesiologia colombiana. Gennaio-marzo 2015; 43 (1): 29-39.
- SAINTS MM, E. Trattamento dell'acidosi lattica rumina acuta con cloruro di sodio ipertonico per via endovenosa o soluzioni di bicarbonato fottute dalle acque intrauminali. Ricerca in scienze veterinarie. Febbraio 2020; 128: 24-34.
- Dini-G. E, Abreu-C. JD, López-M. E. Osmolalità di bevande di consumo frequenti. Ricerca clinica. Dicembre 2004; 45 (4).

