Serie spettrali
- 4872
- 544
- Baldassarre Ross
IL Serie spettrali Sono costituiti da una serie di linee colorate su sfondo scuro o strisce luminose separate da aree scure che emette luce da tutti i tipi di sostanze.
Queste linee sono visualizzate con l'aiuto di uno spettrometro, un apparato che consiste in un prisma o un rack finemente diviso, in grado di separare i diversi componenti della luce.
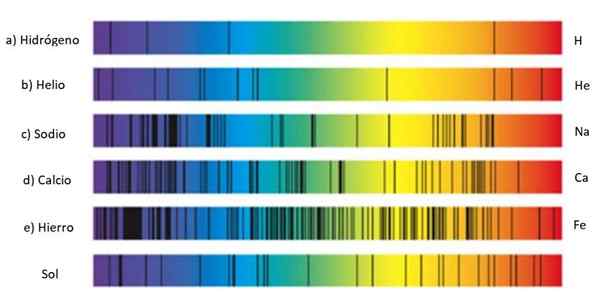
 Spettri di assorbimento di diverse sostanze e sole. Fonte: Wikmedia Commons.
Spettri di assorbimento di diverse sostanze e sole. Fonte: Wikmedia Commons. Queste serie di linee sono chiamate spettro E ogni sostanza ha uno spettro caracaterista, una sorta di impronta digitale che serve a identificare la sua presenza nella luce che proviene da un oggetto. Questo perché ogni atomo ha una propria configurazione di elettroni e consentito i livelli di energia.
Ecco perché trovare le linee spettrali è una tecnica ampiamente utilizzata dagli astronomi per scoprire la composizione delle stelle attraverso la luce che emettono. In effetti, tutto ciò che gli astronomi sanno sulle stelle proviene dai loro spettri, sia emissione che assorbimento.
L'origine degli spettri
La presenza di spettri è dovuta alla configurazione atomica. In effetti, gli elettroni rimangono attorno al nucleo nelle regioni chiamate Orbitali, Situato a alcune distanze discrete da lui.
Ad esempio nell'idrogeno, l'elemento più semplice, le radio orbitali sono fornite da 0.053 ∙ n2 Nanometri, dove n = 1, 2, 3, 4, .. . I valori intermedi non sono consentiti tra loro, quindi si dice che gli orbitali lo siano quantizzato. Anche lo stato energetico di ciascun orbitale è quantizzato.
Tali restrizioni fanno sì che gli elettroni si comportino allo stesso tempo delle particelle e anche delle onde, proprio come la luce. Tuttavia, gli elettroni possono passare da un orbitale all'altro, cambiando lo stato energetico dell'atomo.
Assorbimento ed emissione di energia elettromagnetica
Ad esempio, se un elettrone passa da un orbitale più interno, con meno energia, a un altro più esterno ed energico, è necessario acquisire l'energia elettromagnetica necessaria, che è immagazzinata nell'atomo. Questo processo è chiamato assorbimento.
D'altra parte, se l'elettrone passa da un altro orbitale esterno a uno più interno, nella transizione viene emesso un fotone, in forma di luce, che è l'energia corrispondente alla differenza di energia tra gli orbitali. La lunghezza d'onda corrisponde a questa differenza ed è data da:
Può servirti: Nebula Orion: origine, posizione, caratteristiche e dati
- E è energia
- λ è la lunghezza d'onda
- H è la costante di Planck
- C è la velocità della luce
Tipi di spettri
Esistono spettri di assorbimento ed emissione, che dipendono da alcuni parametri dell'oggetto o della sostanza, come la densità e la temperatura. Lo spettro di un gas debole è diverso da quello di un solido ad alta temperatura.
Spettro continuo
Alcune fonti emettono spettri le cui linee colorate cambiano delicatamente e contengono tutti i colori. Questo è chiamato spettro continuo, ad esempio quello che produce il filamento di una lampadina a incandescenza.
Spettro di emissione
È quello che emette determinate sostanze calde ed è costituito da alcune righe di una certa lunghezza d'onda.
Questo tipo di spettro è prodotto da gas deboli e caldi come quelli che riempiono i tubi fluorescenti. Boreal Aurora è un altro esempio di emissione che si verifica nei gas dell'atmosfera superiore della Terra. Producono anche spettri di emissione Alcune nuvole di gas interstellare.
Spettro di assorbimento
Questo spettro è ciò che viene ricevuto quando la luce di un oggetto denso e molto caldo viene passata attraverso un gas più freddo. In esso si osservano quasi tutti i colori, ma alcuni sembrano diminuiti e alcune strisce scure sorgono in quelle lunghezze d'onda che sono assorbite da atomi o molecole di gas.
Leggi di Kirchoff della spettroscopia
Le leggi di spettroscopia di Kirchoff indicano in quali condizioni sono formati i diversi spettri sopra descritti:
- Spettri continui: vengono emessi da qualsiasi oggetto ad alta pressione e temperatura.
- Gli spettri di emissione: sono prodotti da una bassa pressione a bassa pressione, che emette lunghezze d'onda ben definite, corrispondenti alle transizioni elettroniche corrispondenti a ciascun elemento che costituisce il gas.
- Spettri di assorbimento: sono prodotti da gas a basse temperature situate vicino a caratteri di radiazioni continue. Gli atomi di gas o le molecole assorbono solo alcune lunghezze d'onda.
Lo spettro di emissione di idrogeno
Lo spettro di emissione di idrogeno è particolarmente importante, poiché è l'elemento più abbondante in tutto l'universo e contiene molte informazioni importanti sulle stelle e sulla Via Lattea.
Le linee dello spettro dell'idrogeno sono state scoperte da vari ricercatori e ognuna è nominata.
Serie Balmer
L'idrogeno emette varie linee nello spettro visibile: quando l'elettrone diminuisce da Orbital 3 a Orbital 2 emette la luce rossa, la cui lunghezza d'onda è 656.6 nm, e se decade dall'orbitale da 4 a 2, emette 486 Blue Light.1 nm.
 Spettro di emissione di idrogeno, che mostra le linee corrispondenti alla luce visibile e due linee ultraviolette a sinistra. Fonte: Wikmedia Commons.
Spettro di emissione di idrogeno, che mostra le linee corrispondenti alla luce visibile e due linee ultraviolette a sinistra. Fonte: Wikmedia Commons. Nel 1885 (prima che Bohr proponesse la sua teoria), il matematico e il professore svizzero Johann Balmer (1825-1898) trovò da Tanteo una formula per determinare le lunghezze d'onda di queste righe:
Dove:
- R è costante di Rydberg: 1.097 × 107 M-1
- N = 3, 4, 5 .. ., cioè, n ≥ 3 (intero).
Ad esempio, per n = 3 nell'equazione di Balmer:
Corrispondente alla linea rossa a destra, mostrata nella figura sopra. La scoperta della serie Balmer ha fatto sì che altri scienziati cercino linee nel resto dello spettro dell'idrogeno e altri gas.
Serie Lyman
Si noti che lo spettro dell'idrogeno mostrato nella figura contiene alcune linee in ultraviolette, le due della sinistra estrema, le cui lunghezze d'onda sono 397.0 nm e 388.9. nm.
In effetti, queste linee in ultraviolette corrispondono alla serie Lyman così chiamata, scoperta nel 1906 dal fisico Theodore Lyman. La sua formula è:
Può servirti: BTU (unità termica): equivalenze, usi, esempi)
Serie Paschen
La serie Paschen è stata scoperta dal fisico tedesco Friederich Paschen nel 1908 ed è valida per n ≥ 4, cioè: n = 4, 5, 6 ..
Le linee di paschen si trovano nella regione a infrarossi vicini e il livello finale è n = 3, cioè i loro valori si verificano quando l'elettrone diminuisce da livelli più alti a n = 3. Dato che la serie Lyman è nell'ultravioletta, si è concluso che la serie Balmer è tra Lyman e Paschen.
Serie Brackett
Questa serie scoperta nel 1922 da Frederick Brackett, un fisico americano, si trova nell'infrarosso lontano ed è costituita dalle linee spettrali corrispondenti alle transizioni idrogeno che iniziano a n = 5 e continuano:
Serie pfund
La serie Pfund è stata trovata nel 1924 dal fisico americano August Hermann Pfund e si riferisce alle transizioni che iniziano a n = 5, nella banda a infrarossi lontana:
) Riferimenti
Riferimenti
- Arny, t. 2017. Esplorazioni: un'introduzione all'astronomia. 8 °. Ed. McGraw Hill.
- Bauer, w. 2011. Fisica per ingegneria e scienze. Volume 2. Mc Graw Hill.
- Chang, R. 2013. Chimica. 11va. Edizione. Mc Graw Hill Education.
- Sears, Zemansky. 2016. Fisica universitaria con fisica moderna. 14 °. Ed. Volume 2. Pearson.
- Finestre aperte all'universo. I diversi tipi di spettri. Recuperato da: Media4.Osppm.fr.


)
m^-1=656.3&space;\:&space;nm)
)
)