Seconda legge delle formule termodinamiche, equazioni, esempi

- 2096
- 9
- Baldassarre Ross
IL Seconda legge della termodinamica ha diverse forme di espressione. Uno di questi afferma che nessuna macchina termica è in grado di convertire completamente tutta l'energia che assorbe in un lavoro utilizzabile (formulazione di Kelvin-Planck). Un altro modo per affermarlo è dire che i processi reali si verificano in tale senso che la qualità dell'energia è inferiore perché la Entropia Tende ad aumentare.
Questa legge, nota anche come secondo principio della termodinamica, è stata espressa in diversi modi con il passare del tempo, dall'inizio del XIX secolo ad oggi, sebbene le sue origini risalgano dalla creazione delle prime macchine a vapore in Inghilterra, All'inizio del 18 ° secolo.
 Figura 1. Quando si costruisce i blocchi di costruzione sul pavimento, sarebbe molto sorprendente ordinare. Fonte: Pixabay.
Figura 1. Quando si costruisce i blocchi di costruzione sul pavimento, sarebbe molto sorprendente ordinare. Fonte: Pixabay. Ma sebbene sia espresso in molti modi, in tutta l'idea che la materia tende a disordine e che non esiste sempre un processo del 100%, poiché esiste sempre perdite.
Tutti i sistemi termodinamici aderiscono a questo principio, a partire dall'universo stesso alla tazza di caffè mattutino che aspettano in silenzio sul tavolo scambiando calore con l'ambiente.
Il caffè si raffredda mentre il tempo passa, fino a quando non è in equilibrio termico con l'ambiente, quindi sarebbe molto sorprendente se un giorno si verificherebbe il contrario e l'atmosfera si raffredda mentre il caffè si riscaldava da solo. È improbabile che accada, alcuni lo diranno impossibile, ma è sufficiente immaginarlo avere un'idea del senso in cui le cose accadono spontaneamente.
In un altro esempio, se facciamo scorrere un libro sulla superficie di un tavolo, alla fine si fermerà, perché la sua energia cinetica andrà persa sotto forma di calore a causa dell'attrito.
La prima e la seconda legge della termodinamica furono istituite intorno al 1850, grazie a scienziati come Lord Kelvin -Creatore del termine "Termodinamica" -William Rankine -Auutore del primo testo formale della termodinamica -e Rudolph Clausius.
[TOC]
Formule ed equazioni
Entropia -less che l'inizio -ci sta stabilendo il senso in cui le cose accadono. Torniamo all'esempio dei corpi a contatto termico.
Quando due oggetti a temperature diverse vengono messi in contatto e infine dopo un po 'raggiungono l'equilibrio termico, sono spinti ad esso dal fatto che l'entropia raggiunge il suo massimo, quando la temperatura di entrambi è la stessa è la stessa.
Indicando l'entropia come S, Il cambiamento nell'entropia ΔS di un sistema è dato da:

Il cambiamento di entropia ΔS Indica il grado di disturbo in un sistema, ma c'è una restrizione nell'uso di questa equazione: è applicabile solo ai processi reversibili, cioè quelli in cui il sistema può tornare al suo stato originale senza lasciare un segno di cosa accaduto-.
In processi irreversibili, la seconda legge della termodinamica si manifesta come segue:
Può servirti: numero di reynolds: a cosa serve, come viene calcolato, esercizi
Processi reversibili e irreversibili
La tazza di caffè si raffredda sempre ed è un buon esempio di un processo irreversibile, poiché si verifica sempre in una direzione. Se la crema viene aggiunta al caffè e mescola, verrà ottenuta una combinazione molto piacevole, ma non importa quanto si mescolano di nuovo, il caffè e la crema non saranno più, perché mescolare è irreversibile.
 figura 2. La rottura della tazza è un processo irreversibile. Fonte: Pixabay.
figura 2. La rottura della tazza è un processo irreversibile. Fonte: Pixabay. Sebbene la maggior parte dei processi quotidiani siano irreversibili, alcuni lo sono Quasi Reversibile. La reversibilità è un'idealizzazione. Per essere effettuato, il sistema deve cambiare molto lentamente, in modo che ad ogni punto sia sempre in equilibrio. In questo modo è possibile restituirlo a uno stato precedente senza lasciare un segno in giro.
I processi abbastanza vicini a questo ideale sono più efficienti, poiché offrono una maggiore quantità di lavoro con un minor consumo di energia.
La forza di attrito è responsabile di gran parte dell'irreversibilità, perché il calore generato da essa non è il tipo di energia che viene ricercata. Nel libro che scivola sul tavolo, il calore per attrito è energia che non viene recuperata.
Sebbene il libro ritorni nella sua posizione originale, il tavolo sarà stato caldo come impronta di venire e andare su di esso.
Ora osservi un bulbo a incandescenza: la maggior parte del lavoro svolto dalla corrente che attraversa il filamento viene sprecato in calore da Joule Effect. Solo una piccola percentuale viene utilizzata per emettere luce. In entrambi i processi (libro e bulbo), l'entropia del sistema è aumentata.
Applicazioni
Un motore ideale è quello che è costruito attraverso processi reversibili e manca di attrito che causano rifiuti di energia, girando Quasi Tutta l'energia termica nel lavoro utilizzabile.
Sottolineiamo quasi la parola, perché nemmeno il motore ideale, che è Carnot, ha un'efficienza al 100%. La seconda legge della termodinamica non è in questo modo.
Motore a carnot
Il motore di Carnot è il motore più efficiente che può essere ideato. Funziona tra due depositi di temperatura in due processi isotermici - a temperatura costante - e due processi adiabatici - senza trasferimento di energia termica-.
I grafici chiamati diagrammi PV -pressione - Volume: chiarire la situazione:
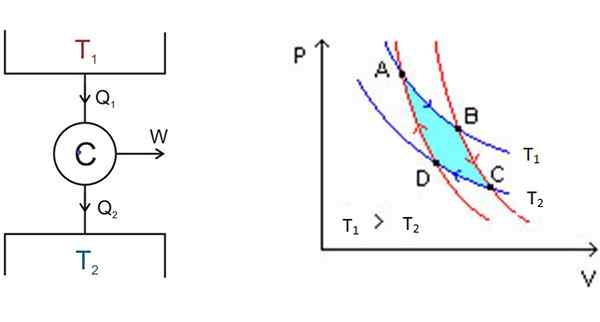 Figura 3. A sinistra lo schema del motore Carnot e a destra il diagramma P-V. Fonte: Wikimedia Commons.
Figura 3. A sinistra lo schema del motore Carnot e a destra il diagramma P-V. Fonte: Wikimedia Commons. A sinistra, nella Figura 3 è lo schema del motore Carnot C, che prende calore Q1 del deposito a temperatura t1, convertire quel calore in lavoro e dargli rifiuti2 al deposito più freddo, che è a temperatura t2.
A partire da A, il sistema si espande fino a quando non raggiunge B, assorbendo il calore a temperatura fissa T1. In B, il sistema inizia un'espansione adiabatica in cui il calore non viene vinto o perso, per arrivare a C.
In C inizia un altro processo isotermico: dare calore all'altro deposito termico più freddo che si trova a T2. In questo modo il sistema viene compresso e il punto D viene raggiunto. Inizia un secondo processo adiabatico per tornare al punto di partenza a. In questo modo viene completato un ciclo.
Può servirti: trasferimento di calore guidando (con esempi)L'efficienza di Carnot dipende dalle temperature di Kelvin dai due depositi termici:
Massima efficienza = (QEntrata - QUscita) /QEntrata = 1 - (t2/T1)
Il teorema di Carnot afferma che questa è la macchina termica più efficiente, ma non affretta a acquistarla. Ricordi quello che abbiamo detto sulla reversibilità dei processi? Devono accadere molto, molto lentamente, quindi la potenza di uscita di questa macchina è praticamente zero.
Metabolismo umano
Gli esseri umani hanno bisogno di energia per far funzionare tutti i loro sistemi, quindi si comportano come macchine termiche che ricevono energia e la trasformano in energia meccanica per, ad esempio, muoversi.
Efficienza E del corpo umano quando si fa un lavoro può essere definito come il rapporto tra il potere meccanico che può fornire e l'ingresso totale di energia, che viene fornito con il cibo.
Come la potenza media pM È W di lavoro fatto in un intervallo di tempo Δt, Può essere espresso come:
PM = W/ΔT
Sì ΔU/ΔT È la velocità con cui viene aggiunta l'energia, l'efficienza corporea rimane:

Attraverso numerosi test con volontari, sono state ottenute efficienze fino al 17%, fornendo circa 100 watt di energia per diverse ore.
Naturalmente, ciò dipenderà in gran parte dall'attività che viene svolto. Pedalare di una bicicletta ha un po 'di efficienza un po' maggiore, di circa il 19 %, mentre compiti ripetitivi che includono pale, picchi e zappe hanno un'efficienza fino a circa il 3 %.
Esempi
La seconda legge della termodinamica è implicita in tutti i processi che si verificano nell'universo. L'entropia cresce sempre, anche se in alcuni sistemi sembra diminuire. Affinché ciò sia aumentato altrove, in modo che nel bilanciamento totale sia positivo.
- Nell'apprendimento c'è entropia. Ci sono persone che imparano le cose bene e in fretta, oltre a poterle ricordare facilmente. Si dice che siano persone con un apprendimento a bassa entropia, ma sono sicuramente meno numerosi di quelli di alta entropia: coloro che hanno più ricordano le cose che studiano.
- Una società con lavoratori disorganizzati ha più entropia di una in cui i lavoratori svolgono compiti in modo ordinato. È chiaro che quest'ultimo sarà più efficiente del primo.
- Le forze di attrito generano una minore efficienza nel funzionamento dei macchinari, poiché aumentano la quantità di energia dissipata che non può essere utilizzata in modo efficiente.
- Il lancio di un dado ha un'entropia maggiore che gettare una moneta in aria. Dopotutto, il lancio di una valuta ha solo 2 possibili risultati, mentre il lancio dei dadi è 6. Più eventi sono probabili, più entropia esiste.
Può servirti: quali sono gli elementi del movimento?Esercizi risolti
Esercizio 1
Un cilindro con un pistone viene riempito con una miscela di vapore liquido e acqua a 300 K e 750 kJ di calore viene trasferito in un processo di pressione costante. Di conseguenza, il liquido all'interno del cilindro viene vaporizzato. Calcola il cambiamento di entropia nel processo.
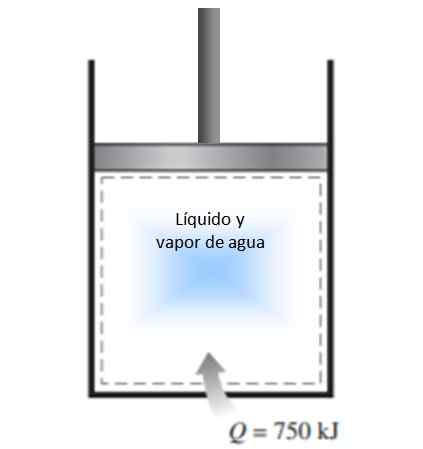 Figura 4. Figura per l'esempio risolto 1. Fonte: f. Zapata.
Figura 4. Figura per l'esempio risolto 1. Fonte: f. Zapata. Soluzione
Il processo descritto nella dichiarazione viene effettuato a costante pressione in un sistema chiuso, che non sperimenta lo scambio di massa.
Poiché si tratta di vaporizzazione, durante la quale la temperatura non cambia (durante i cambiamenti di fase la temperatura è costante), la definizione di variazione di entropia indicata sopra può essere applicata e la temperatura può lasciare fuori dall'integrale:

ΔS = 750.000 J / 300 K = 2500 J / K.
Poiché il sistema arriva al sistema, il cambiamento nell'entropia è positivo.
Esercizio 2
Un gas subisce un aumento della pressione di 2.00 a 6.00 atmosfere (ATM), mantenendo un volume costante di 1.00 m3, e quindi espandersi a pressione costante fino a raggiungere un volume di 3.00 m3. Finalmente torna al suo stato iniziale. Calcola quanta lavoro viene svolto in 1 ciclo.
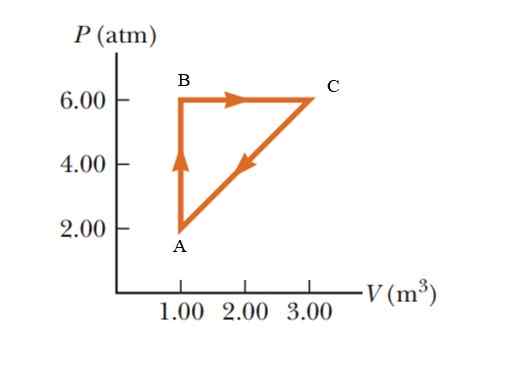 Figura 5. Processo termodinamico in gas per esempio 2. Fonte: Serway -Vulle. Fondamenti di fisica.
Figura 5. Processo termodinamico in gas per esempio 2. Fonte: Serway -Vulle. Fondamenti di fisica. Soluzione
È un processo ciclico in cui è nullo la variazione di energia interna, secondo la prima legge della termodinamica, quindi Q = W. In un diagramma P -V (volume di pressione), il lavoro svolto durante un processo ciclico è equivalente all'area bloccato dalla curva. Per dare i risultati nel sistema internazionale è necessario modificare le unità nella pressione attraverso il seguente fattore di conversione:
1 atm = 101.325 kPa = 101.325 pa.
L'area racchiusa dal grafico corrisponde a quella di un triangolo la cui base (3 - 1 m3) = 2 m3 e la cui altezza è (6 - 2 atm) = 4 atm = 405.300 pa
WABCA = ½ (2 m3 x 405300 PA) = 405300 J = 405.3 kj.
Esercizio 3
Si dice che una delle macchine più efficienti che sono state costruite sia una turbina a vapore alimentata dal carbone sul fiume Ohio, che viene utilizzato per guidare un generatore elettrico che opera tra il 1870 e il 430 ° C.
Calcola: a) Efficienza teorica massima, b) la potenza meccanica erogata dalla macchina se assorbita 1.40 x 105 J di energia ogni secondo dal serbatoio caldo. È noto che la vera efficienza è 42.0%.
Soluzione
a) La massima efficienza viene calcolata con l'equazione sopra indicata:
Massima efficienza = (QEntrata - Q Uscita) /QEntrata = 1 - (t2/T1)
Per passare il Celsius a Kelvin, è sufficiente aggiungere 273.15 alla temperatura di Celsius:
Moltiplicando per il 100% hai la massima efficienza percentuale, che è 67.2%
c) Se la vera efficienza è del 42%, esiste una massima efficienza di 0.42.
La potenza meccanica erogata è: p = 0.42 x 1.40 x10 5 J/s = 58800 W.
Riferimenti
- Bauer, w. 2011. Fisica per ingegneria e scienze. Volume 1. Mc Graw Hill.
- Cengel, e. 2012. Termodinamica. 7Ma Edizione. McGraw Hill.
- Figueroa, d. (2005). Serie: Physics for Science and Engineering. Volume 4. Fluidi e termodinamica. A cura di Douglas Figueroa (USB).
- Cavaliere, r. 2017. Fisica per scienziati e ingegneria: un approccio strategico.
- López, c. La prima legge della termodinamica. Recuperato da: Culturacientifica.com.
- Serway, r. 2011. Fondamenti di fisica. 9n / a Apprendimento del Cengage.
- Siviglia University. Macchine termiche. Recuperato da: Laplace.noi.È
- « Principi, periodi e schemi della teoria dell'avvocato
- Cambiamenti dei tipi di stato e le loro caratteristiche (con esempi) »


=0.672)