Riduzione (chimica)
- 1395
- 230
- Lidia Valentini
 Riduzione dell'albero d'argento. Fonte: Gabriel Bolívar
Riduzione dell'albero d'argento. Fonte: Gabriel Bolívar Qual è la riduzione?
IL riduzione È tutta quella reazione chimica in cui gli atomi di uno dei reagenti finiscono per guadagnare elettroni, che possono anche essere visti in questo modo: il suo posto vacante o il "disagio" elettronico è ridotto. Un atomo guadagna elettroni quando una specie li dona, cioè quando ossidati.
Questo tipo di reazione non può essere dato da solo: se una specie accetta elettroni, un'altra deve necessariamente darli. Altrimenti, la materia non sarebbe creata dal nulla, riducendo gli atomi dopo aver guadagnato elettroni vuoti. Pertanto, è una semi -luce redox (riduzione/ossidazione).
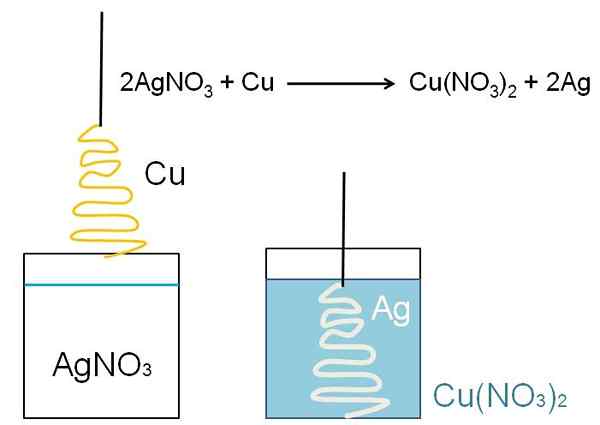
Un esempio illustrativo della riduzione che può essere mostrato in classe è la reazione tra una superficie di rame metallico e una soluzione acquosa di nitrato d'argento, AGNO3.
Nella soluzione, l'argento è come cationi AG+, caricato positivamente. Questi, quando interagiscono con la superficie del rame, sotto forma di albero di Natale, gli elettroni sono presi dagli atomi di rame. Quando ciò si verifica, il rame sostituisce l'argento nel sale di nitrato e, di conseguenza, si forma il nitrato di rame, no3)2.
Cu cationi2+ Accanto a no3- Bluasono la soluzione e l'argento incarna l'albero di Natale come se coprisse la neve.
Qual è la riduzione?
Nella riduzione è già stato detto che una specie guadagna elettroni. Come può essere controllato in un'equazione chimica? Ad esempio, nell'equazione di reazione tra Cu e AGNO3, Come sapere quando si verifica la riduzione? Per verificarlo, è necessario determinare il numero o lo stato di ossidazione.
Può servirti: elettronegativitàGli elementi, nei loro stati naturali, hanno come definizione uno stato di ossidazione pari a zero, poiché si presume che non abbiano perso o vinto elettroni. Pertanto, i metalli solidi hanno uno stato di ossidazione zero. Pertanto, l'argento passa da +1 (AG+) A 0 (Ag). Il carico di uno ione metallico è uguale al suo stato di ossidazione.
D'altra parte, gli elettroni provenivano dal rame: spostarsi da 0 (Cu) a +2 (CU2+). L'anione nitrato, no3- rimane inalterabile mentre entrambi i metalli scambiano elettroni. Pertanto, l'equazione può essere scritta come:
2ag+ + Cu => 2ag + cu2+
Si noti che sia i carichi che gli atomi sono bilanciati.
Ciò consiste nella riduzione chimica: nel guadagno degli elettroni che rendono gli stati di ossidazione degli atomi che gli elettroni guadagnano meno positivi.
Numero di ossigeno
L'ossigeno sono atomi molto elettronegativi e ossidanti, quindi quando si forma un atomo composto con loro (come gli ossidi), hanno stati di ossidazione positivi. Maggiore è il numero di ossigeno che interagisce con l'atomo, più positivo sarà la sua ossidazione. O qual è lo stesso, è più ossidato.
Pertanto, quando un composto ha meno atomi di ossigeno, si dice che sia meno ossidato. Cioè, l'atomo perde meno elettroni.
Un esempio classico può essere visto in monossido e anidride carbonica. Per CO, il carbonio ha uno stato di ossidazione di +2, mentre per CO₂, il suo stato di ossidazione è +4.
Quindi, se in una reazione il CO₂ si trasforma in CO, si dice che si sta verificando una riduzione, poiché il carbonio ora interagisce con un ossigeno e non due. Per la reazione opposta, co -trasformando, si parla di un'ossidazione del carbonio.
Può servirti: cloruro ferroso (FECL2): struttura, usi, proprietàQuesto vale per tutti gli atomi, in particolare i metalli nei loro ossidi metallici. Ad esempio, CRO2 (Cr4+) e Cro3 (Cr6+).
Nelle equazioni chimiche, in cui una specie perde ossigeno mentre l'altra specie lo guadagna, si dice che si verifichi un trasferimento di ossigeno.
Atomo elettronegativo
Può sempre essere determinato se c'è stata una riduzione cambiando lo stato di ossidazione in un valore meno positivo. Come hai appena spiegato, un modo rapido per notarlo senza nemmeno fare i calcoli è osservare se c'è una diminuzione degli atomi di ossigeno in un composto.
Lo stesso può accadere con qualsiasi altro atomo più elettronegativo dell'atomo che vince o perde elettroni.
Ad esempio, se il CF4 reagisce in modo tale che diventa Cho4, Si dice quindi che si sia verificata una riduzione, poiché il fluoruro è molto più elettronegativo dell'atomo di idrogeno. Di conseguenza, il carbonio è meno ossidato in Cho4 che nel CF4, Questo è lo stesso per dire che è stato ridotto.
Esempi
Riduzione della chimica organica
L'esempio della CF4 e ch4 Riflette ciò che accade nelle reazioni organiche, in cui la riduzione del carico parziale di un atomo è considerata come guadagno elettronico. Questo vale notevolmente se si considerano la riduzione dei gruppi funzionali ossigenati.
Ad esempio, considera i gruppi ROH, RCHO e COOH. Il primo corrisponde agli alcoli, in cui il carbonio è legato all'ossigeno (C-OH); Il secondo è il gruppo di aldeide, in cui il carbonio forma il legame con ossigeno ed è anche collegato a un idrogeno (c = o-h) e il terzo è il gruppo carbossilico.
Può servirti: idrossido di beryl (be (oh) 2)Nel gruppo carbossilico, il carbonio forma un doppio legame con un O e un semplice collegamento con un altro O (Ho-C = O).
Pertanto, si verifica una riduzione se un acido carbossilico viene trasformato in alcol:
Rcooh => roh
Estrazione metallica
La riduzione chimica è estremamente importante nei processi di estrazione dei metalli dai loro minerali. Alcune delle reazioni sono:
HGS + O2 => Hg + SO2
Il solfuro di mercurio è ridotto al mercurio metallico.
Cu2S + o2 => 2Cu + SO2
Il solfuro di rame al rame metallico è ridotto.
2zns + 3o2 => 2zno + 2so2
ZnO + C => Zn + Co (Nota il trasferimento di O).
Il solfuro di zinco viene prima ridotto al suo monossido e poi alla sua forma metallica.
Fede2O3 + 3co => 2fe + 3co2
L'ossido ferrico è ridotto al ferro metallico.
Wo3 + 3h2 => W + 3h2O
E il triossido di tungsteno è ridotto al tungsteno metallico.
Come esercizio, il numero di ossidazione del metallo può essere determinato prima di essere ridotto.
Altri esempi
- Ione di ferro (III) può essere ridotto a ferro (II):
- Etino può essere ridotto a Eteno:
- L'etanale può essere ridotto all'etanolo
Riferimenti
- Reazioni di riduzione dell'ossidazione. Chimica recuperata.Librettexts.org.
- La definizione di riduzione in chimica. Recuperato da Thoughtco.com.




