Reazioni esotermiche ed endotermiche
- 661
- 95
- Dante Morelli
 La combustione è un esempio di reazione esotermica, poiché rilascia calore. Da parte sua, il ghiaccio si scioglie attraverso una reazione endotermica, poiché richiede energia termica
La combustione è un esempio di reazione esotermica, poiché rilascia calore. Da parte sua, il ghiaccio si scioglie attraverso una reazione endotermica, poiché richiede energia termica IL reazioni esotermiche ed endotermiche Differiscono nel fatto che la prima energia termica a rilascio, mentre quest'ultima la assorbita, secondo i cambiamenti di calore che si verificano durante le reazioni chimiche.
Allo stesso modo, altri tipi di energia possono essere coinvolti nelle reazioni chimiche, poiché a volte durante la reazione, l'energia luminosa, l'energia sonora e persino l'elettricità viene prodotta.
Per tenere conto non solo del calore, ma di altri tipi di energia, le reazioni chimiche sono classificate come esergonico E Endermanics. Una reazione esergonica rilascia energia quando prodotta, mentre un entegonico la assorbe.
In questo caso, una reazione esotermica è anche una reazione esergonica, in quanto rilascia calore. Uno degli esempi più familiari è la combustione. Ogni volta che viene bruciato un pezzo di legno, viene rilasciata un'energia calorica e brillante.
D'altra parte, una delle reazioni chimiche endergiusali più note si verifica quando si scioglie un cubetto di ghiaccio, poiché il ghiaccio assorbe l'energia termica dell'ambiente per trasformarsi in acqua liquida.
Una reazione esotermica può verificarsi spontaneamente, anche se a volte è necessario fare un po 'di lavoro per iniziare. Tuttavia, affinché si verifichi una reazione endotermica, è sempre necessario che l'ambiente svolga un lavoro sul sistema.
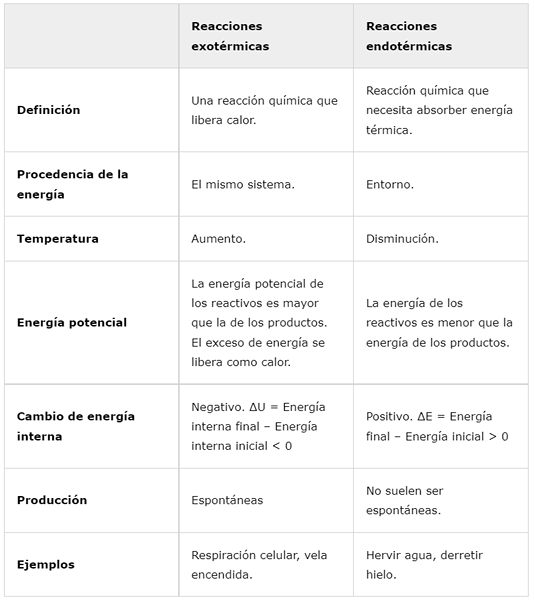
Reazioni esotermiche | Reazioni endotermiche | |
Definizione | Una reazione chimica che rilascia calore. | Reazione chimica che deve assorbire l'energia termica. |
Origine dell'energia | Lo stesso sistema. | In giro. |
Temperatura | Aumento. | Diminuire. |
Energia potenziale | L'energia potenziale dei reagenti è maggiore di quella dei prodotti. L'energia in eccesso viene rilasciata come calore. | L'energia dei reagenti è inferiore all'energia dei prodotti. |
Cambio di energia interna | Negativo. ΔU = energia interna finale - energia interna iniziale < 0 | Positivo. ΔE = energia finale - energia iniziale> 0 |
Produzione | Spontaneo | Di solito non sono spontanei. |
Esempi | Respirazione cellulare, candela bruciante. | Fai bollire l'acqua, scioglie il ghiaccio. |
Reazioni esotermiche
Definizione
Tipo di reazione chimica che rilascia calore quando viene eseguito.
Può servirti: cicloesco: struttura, proprietà, sintesi e usiOrigine dell'energia
Lo stesso sistema fornisce energia in modo che la reazione si verifichi.
Temperatura
Dopo la reazione c'è un aumento di temperatura.
Energia potenziale
Quando si verifica una reazione chimica tra i reagenti, si formano collegamenti tra loro e altri per creare nuove molecole. Ma non tutti i collegamenti uniscono atomi e molecole con la stessa forza, quindi l'energia per rompere o creare ogni collegamento è diversa.
Durante ogni reazione si rompono e creano numeri diversi di collegamenti, quindi l'energia è diversa. In una reazione esotermica, l'energia potenziale dei reagenti è più vecchio di quello dei prodotti, e poiché l'energia viene conservata, l'eccesso viene rilasciato come calore.
Cambio di energia interna
L'energia interna è correlata alla capacità del sistema di svolgere lavori e include la sua energia potenziale e l'energia cinetica. L'energia assoluta del sistema non è determinata, ma la sua variazione, chiamata ΔU.
Secondo quanto detto nella sezione precedente, il cambiamento di energia interna ΔU è negativo.
ΔU = energia interna finale - energia interna iniziale < 0
Produzione
La maggior parte delle reazioni esotermiche sono spontaneo, Cioè, si svolgono per se stessi, senza la necessità di aggiungere energia esterna, fino a quando i reagenti non sono esauriti.
Esempi
Normalmente, le reazioni di ossidazione e quelle che portano alla formazione di composti sono generalmente reazioni esotermiche:
1. Dissolvere il detergente in acqua
Quando si dissolve la polvere di abbigliamento in un po 'di acqua fredda, si sente caldo quando lo tocca.
2. Respirazione cellulare
Negli animali e nelle piante, il processo di respirazione cellulare viene effettuato come parte del ciclo del carbonio. La respirazione utilizza glucosio e ossigeno per restituire anidride carbonica, acqua ed energia, secondo la reazione:
Può servirti: ossido di titanio (IV): struttura, proprietà, usiC6H12O6 + 6 °2 → 6co2 + H2O + Energy (ATP)
3. Una candela in fiamme
Oltre alla luce, una candela in fiamme emana calore e altre sostanze:
Ossigeno ossigeno → acqua + anidride carbonica + luce e calore
4. Lo scarabeo di bombardamento
Questo insetto si difende spruzzando un aerosol sui suoi predatori. Lo scarabeo mantiene fluidi e enzimi in compartimenti separati, situati nell'addome.
Se minacciato, espelle i fluidi verso il compartimento enzimatico e una reazione chimica che genera vapore e calore viene prodotta, fungendo da repellente per possibili predatori.
5. Lana d'acciaio e aceto
Un metallo come il ferro viene lentamente ossidato quando reagisce con l'ambiente, ma se l'aceto viene aggiunto a una piccola lana d'acciaio, si osserva che l'ossidazione è molto più veloce e allo stesso tempo genera calore.
Reazioni endotermiche
Definizione
Reazioni in cui i reagenti devono assorbire l'energia termica in modo da ottenere i prodotti.
Origine dell'energia
L'energia necessaria per la reazione da eseguire proventi dall'ambiente.
Temperatura
La reazione endotermica comporta a diminuire di temperatura.
Energia potenziale
A differenza di ciò che accade con una reazione esotermica, l'energia dei reagenti È meno che l'energia dei prodotti.
Cambio di energia interna
In una reazione endotermica, il cambiamento di energia interna ΔE è positivo.
ΔE = energia finale - energia iniziale> 0
Pertanto, l'energia finale è maggiore della iniziale.
Produzione
Le reazioni endotermiche richiedono che il lavoro sul sistema venga eseguito, quindi di solito non sono spontanei.
Tuttavia, ci sono alcune reazioni endotermiche, come la fusione del ghiaccio e l'evaporazione di alcuni liquidi, che sono spontanei a temperatura ambiente.
Si è concluso quindi che la temperatura dell'ambiente è un fattore determinante nella spontaneità di una reazione chimica.
Può servirti: indicatori chimici: a cosa servono, tipi, esempiEsempi
Molte delle reazioni che coinvolgono la dissoluzione dei sali e, in generale, la decomposizione delle sostanze, sono generalmente endotermiche. Allo stesso modo, il passaggio del ghiaccio in acqua liquida e dell'acqua liquida a vapore, cioè le trasformazioni dello stato, sono anche reazioni endotermiche.
1. Fotosintesi
Le piante eseguono una reazione chimica in presenza di luce solare, in cui convertono l'anidride carbonica e l'acqua in glucosio e ossigeno. La clorofilla è la molecola chiave in questo processo, la cui reazione chimica è:
Luce + 6co2 + H2O → c6H12O6 + 6 °2
Come si può vedere, è la reazione inversa della respirazione. Per produrre un chilogrammo di glucosio, sono necessari 15 mega joule di energia solare.
2. Fai bollire l'acqua e cuocere
Una reazione molto comune, che richiede energia per procedere, è l'acqua bollente:
H2O (liquido) + energia → H2O (vapore)
Gli alimenti normalmente richiedono acqua per cucinare e allo stesso modo l'acqua che contengono evaporarli per cucinarli, il che prevede un cambiamento di stato.
3. Per sciogliere il ghiaccio
Allo stesso modo, è comune che il ghiaccio si sciolga a temperatura ambiente, se questo è maggiore di 0 ° C:
H2O (solido) + energia → H2O (liquido)
Pertanto, la bevanda si raffredda quando si aggiunge ghiaccio, poiché assorbe l'energia necessaria per cambiare lo stato dal liquido.
4. Sacchi freddi
Sono usati per trattare lividi e colpi. Contenere acqua e una busta con cloruro di ammonio. Quando toccano la borsa, la busta è rotta e la reazione del cloruro di ammonio con acqua, che è endotermica, raffredda la borsa e allevia il dolore.
5. Produzione di ozono
Le radiazioni ultraviolette dal sole trasformano l'ossigeno in ozono, rilasciando calore nel processo.
3 °2 (gas) + luce ultravioletta → 2nd3 (gas)
Riferimenti
- Byju's. Differenza tra reazioni edotermiche ed esotermiche. Recuperato da Byjus.com
- Chang, R. (2013). Chimica. 11va. Edizione. McGraw Hill Education.
- Grelane. Reazioni esotermiche per riscaldare le cose. Recuperato da: Grelane.com.
- Hein, m. (2014). Fondazioni di chimica del college. Wiley.
- Helmestin, a. Comprensione delle reazioni endotermiche ed esotermiche. Recuperato da: Thoughtco.com

